漫談m6A修飾
N6-甲基腺苷(M6A)是最常見、最豐富和最保守的內部轉錄修飾,由m6A甲基轉移酶(METTL3/14,WTAP,RBM15/15B和KIAA1429,稱為“writers”)安裝,由脫甲基酶(FTO和ALKBH5,稱為“erasers”)還原,并被m6A結合蛋白(YTHDF1/2/3,IGF2BP1和hnRNPA2B1,稱為“readers”)識別。
m6A RNA甲基化對RNA的產生/代謝有很大的影響,參與了包括癌癥在內的多種疾病的發病機制。接下來,就和小編一起看一看m6A修飾在人類癌癥生物學功能中的最新進展。
METTL3和FTO參與調控CCAAT-增強子結合蛋白(CEBP)家族的轉錄。
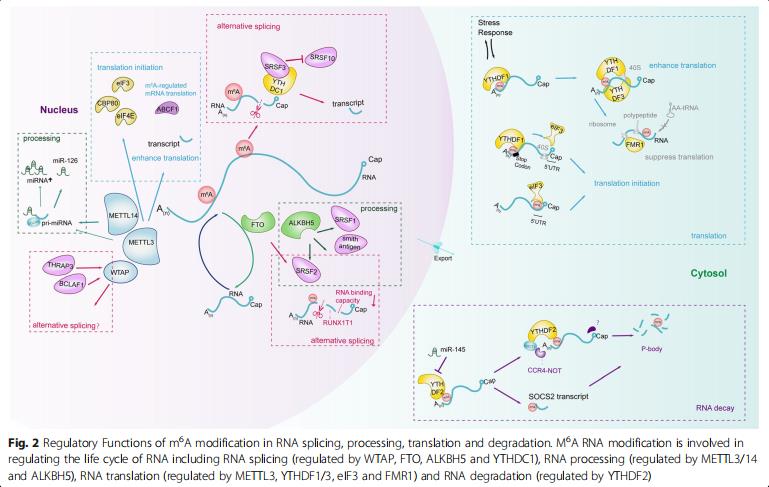
m6A修飾促進miRNA生物發生的啟動,并調節核mRNA加工。
與剪接增強子區域在空間重疊的m6A RNA修飾通過充當關鍵的pre-mRNA剪接調節因子來影響可變RNA剪接。m6A甲基轉移酶的抑制作用影響基因表達和選擇性剪接模式。
m6A是細胞質mRNA穩定性的決定因素,降低了mRNA穩定性。
m6A修飾發生在mRNA和非編碼RNA(NcRNAs)中,以調節其5‘或3’UTR的基因表達。
m6A的甲基轉移酶和去甲基酶與多種疾病有關,如肥胖、II型糖尿病(T2 DM)、生長發育遲緩、面部畸形等。此外,m6A修飾還會影響不孕不育癥、發育停滯、神經元紊亂和感染性疾病。
1.代謝性和感染性疾病中的m6A修飾
M6A修飾參與T2 DM和肥胖患者的代謝異常。FTO通過FTO依賴的m6A去甲基化調節能量平衡和多巴胺能途徑,影響脂肪生成中的Runx1t1剪接。METTL3/14降低丙型肝炎病毒復制的豐度,但FTO通過YTHDF蛋白促進其產生。M6A在黃病毒科中被鑒定為一個保守的調節符號。
2.不孕癥中的m6A修飾
脫甲基酶ALKBH5缺乏導致精子發生和凋亡異常,睪丸生殖力受損,DNA甲基轉移酶1(Dnmt1)和泛素樣PHD和RING finger domains 1(Uhrf1)發生明顯變化。YTHDC1/2決定小鼠生殖系的發育,YTHDC1對雄性精原細胞和雌性卵母細胞成熟是必不可少的。
3.神經系統發育中的m6A修飾
M6A修飾調節大腦皮層發育的速度,M6A調節的組蛋白修飾通過METTL3/14增強神經干細胞的自我更新。M6A通過兩種不同的途徑對延緩皮質發生速度起雙重作用:增加細胞周期長度和減少mRNA衰減。M6A耗盡減少了與干細胞維持、神經發生和分化相關的放射狀膠質細胞的衰變。
4.炎癥和代謝相關癌癥中的m6A修飾
METTL3/14和FTO影響丙型肝炎病毒的復制和產生,而炎癥反應的內源性介質可以促進遺傳/表觀遺傳改變。FTO在脂肪生成中影響RUNX1T1剪接,并且RUNX1T1對于胰腺發育是必需的。轉錄因子Forkhead box protein O1(FOXO1)作為FTO的另一種直接底物,調節肝臟的糖異生,促進胰腺導管癌的生長。
新出現的證據表明,m6A修飾與腫瘤的增殖、分化、發生、增殖、侵襲和轉移有關,在惡性腫瘤中起癌基因或抑癌基因的作用。
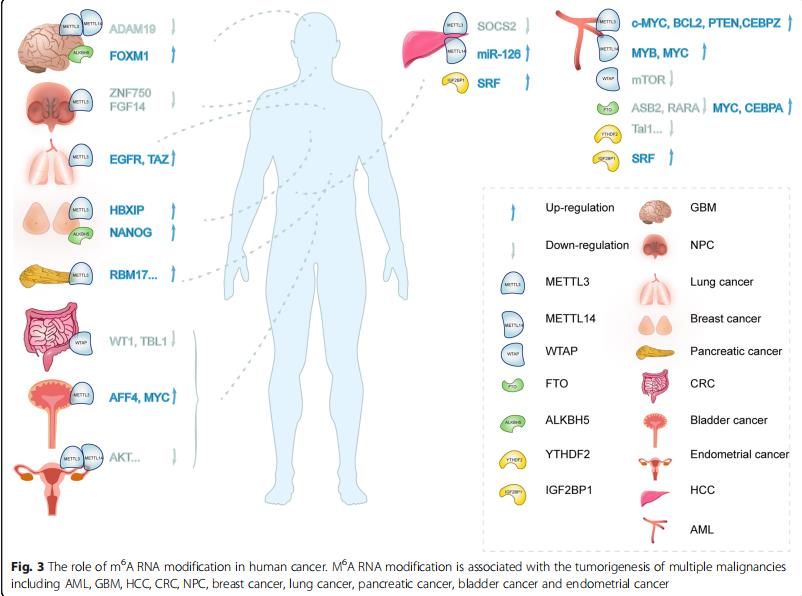
1.急性髓系白血病(AML)
了m6A修飾在白血病中起著重要作用,例如METTL3,METTL14,FTO和YTHDF2,它們為AML的發展和維持以及通過下游MYC和TAL1途徑的白血病干細胞/起始細胞的自我更新提供了深刻的見解。
2.惡性膠質瘤 / 成膠質細胞瘤(GBM)
METTL3/14抑制GSC生長、自我更新和腫瘤發生,但FTO和ALKBH5通過調節ADAM19和轉錄因子FOXM1在GBM中顯示較差的存活率。FOXM1反義的lncRNA(FOXM1-AS)促進ALKBH5與FOXM1新生轉錄本在GSCs的腫瘤發生中的相互作用。
3.肺癌
M6A脫甲基酶FTO被鑒定為肺鱗狀細胞癌(LUSC)的預后因子,促進細胞增殖和侵襲,但通過調節MZF1表達抑制細胞凋亡。METTL3的SUMO化對于促進非小細胞肺癌(NSCLC)中賴氨酸殘基K177,K211,K212和K215的生長具有重要意義。
4.肝細胞癌(HCC)
METTL3上調或METTL14下調可預測HCC患者的預后較差,并有助于HCC的進展和轉移。METTL3通過miR-145/m6A/YTHDF2依賴軸抑制肝癌中SOCS2的表達。
5.乳腺癌和結直腸癌(CRC)
METTL3與哺乳動物乙型肝炎X相互作用蛋白(HBXIP)的表達有關,在乳腺癌中表現出侵襲性。ALKBH5降低NANOG mRNA中m6A的水平,增強其穩定性,導致乳腺癌干細胞(BCSC)中NANOG mRNA和蛋白水平的增加。m6A“writer”WTAP與CA4有關,CA4通過靶向WTAP-WT1-TBL1軸抑制Wnt信號轉導,抑制細胞增殖,誘導凋亡和周期阻滯。
m6A RNA修飾通過調節RNA轉錄、剪接、加工、翻譯和衰變,參與多種惡性腫瘤的發生和轉移,但癌癥中m6A修飾的潛在機制仍然需要進一步研究。除FMR1和LRPPRC外,ALKBH家族在m6A RNA甲基化中的作用尚未確定。METTL14在不同的腫瘤組織中有不同的表達水平。鑒于METTL14在癌癥中具有腫瘤抑制因子或原癌基因的雙重作用,其在其他癌癥中的作用需要進一步闡明。雖然一些m6A甲基化抑制劑對腫瘤的發展有很好的效果,但m6A RNA甲基化的新治療策略應該在癌癥的治療中得到進一步的探索。
參考文獻:
Xiao-Yu C, Zhang J, Zhu J S. The role of m6A RNA methylation in human cancer[J]. Molecular Cancer, 2019, 1






