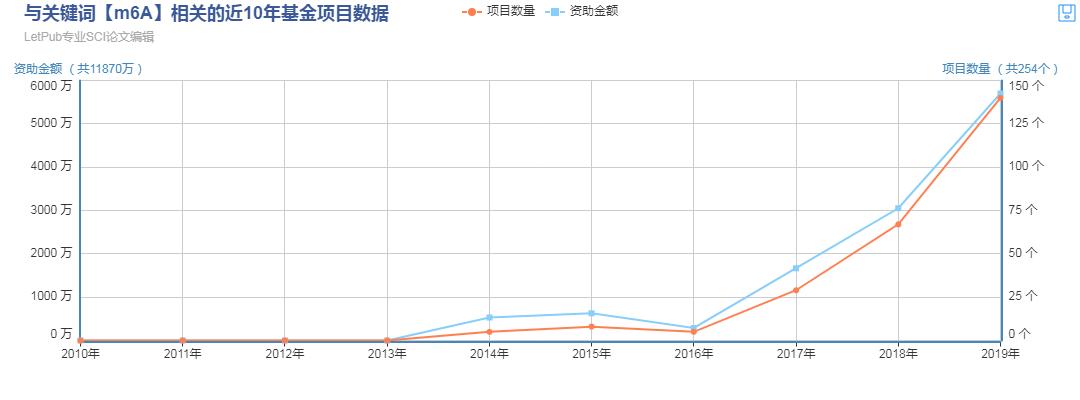
國自然熱門領域之m6A
m6A是一種動態可逆的修飾方式,在轉錄后調控中發揮作用,其在調控基因表達、剪接、RNA 編輯、RNA 穩定性、控制mRNA壽命和降解、介導環狀RNA翻譯等方面扮演重要角色,具有重要的研究意義。國自然基金申請上,m6A RNA甲基化相關項目增長喜人。2019年有140個中標項目與m6A甲基化相關,較2018年67個中標項目,同比增長109%。文章產出上也連年增長,其高質量文章不斷。可以預見在未來三到五年內,m6A甲基化仍會是熱門研究領域,且研究產出呈爆炸增長。
今天我們來講一篇m6A甲基化參與調節腫瘤干性和化療敏感性的文章。該文章發表于Molecular Cancer期刊,期刊影響因子為10.679,該期刊近年來影響因子逐年上漲,質量較高。文章題名為:m6A modification-mediated CBX8 induction regulates stemness and chemosensitivity of colon cancer via upregulation of LGR5。該文章講述了m6A修飾后CBX8通過上調LGR5表達調節結腸癌(CC)的干性和化療敏感性。

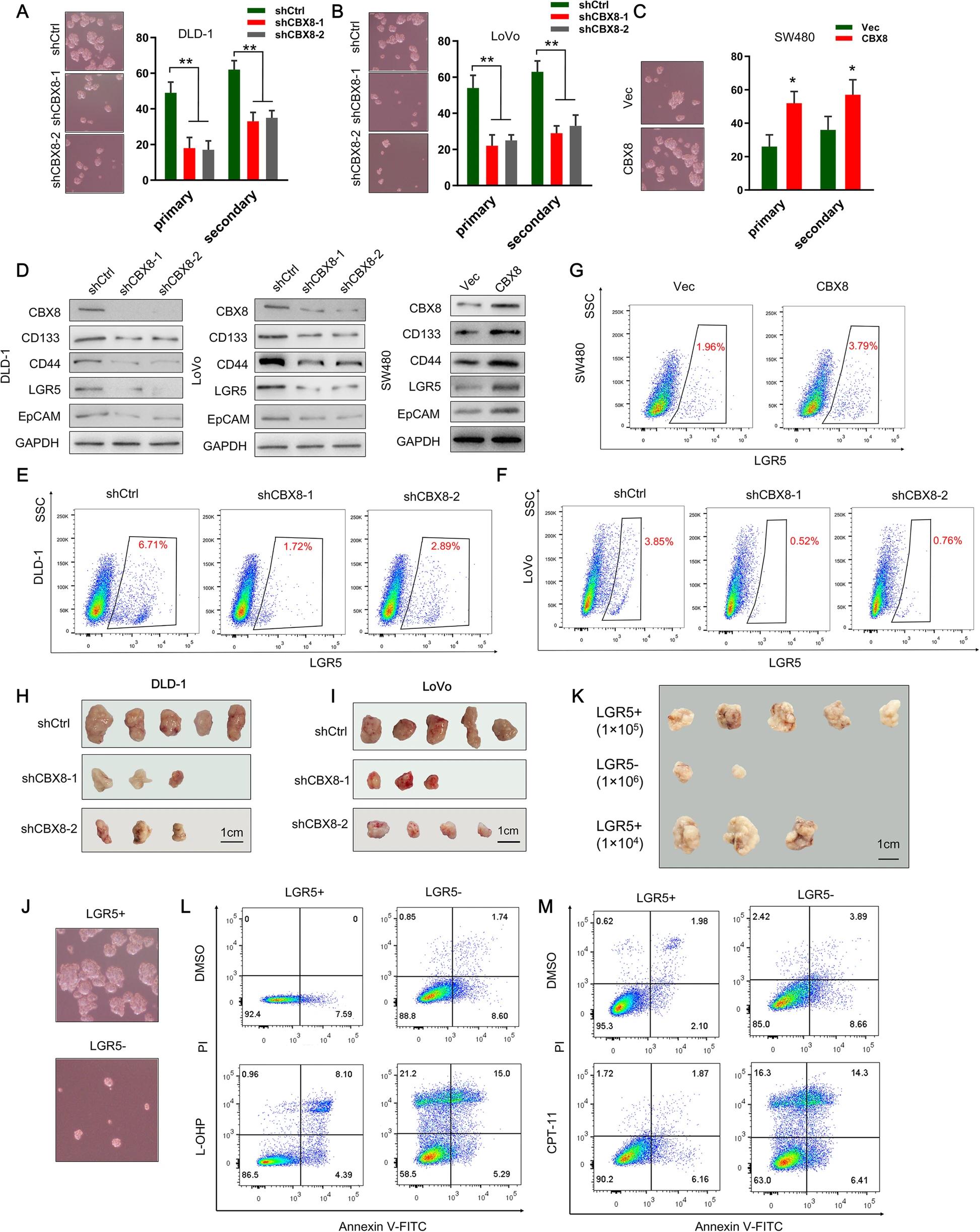
一、CBX8維持CC細胞的干性
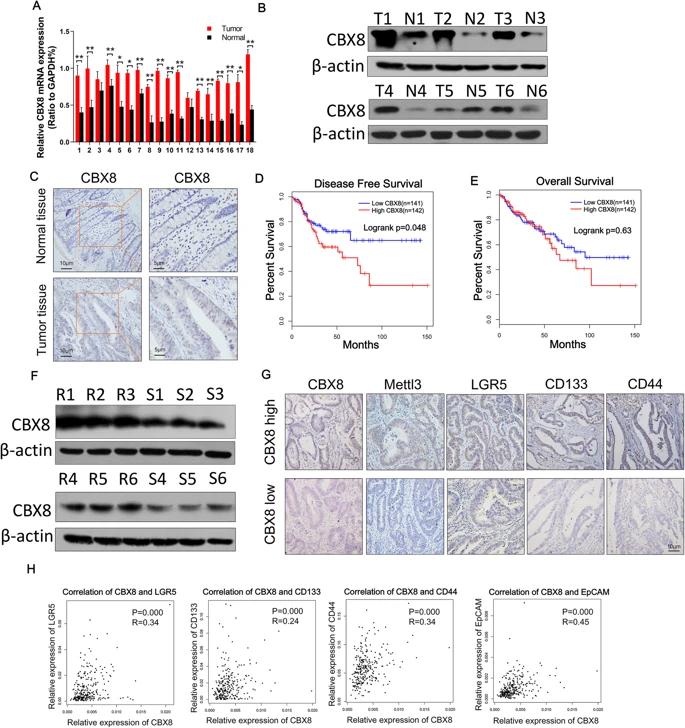
通過TCGA和GTEx數據庫分析正常結腸組織和CC組織中CBX蛋白的mRNA表達譜,發現CC組織中CBX2,CBX4和CBX8的表達顯著上調。又通過IHC檢測三種蛋白在抗化療CC組織中的表達,抗化療CC組織中CBX8的表達高于正常組織。由于化療抗性是癌癥干性的關鍵特征,因此研究了CBX8對CC細胞干性特征的影響。相對于正常上皮細胞系,CBX8在CC細胞系中過表達。抑制CBX8可降低CC細胞初級和次級成球能力;相反,過表達CBX8增強初級和次級成球能力。腫瘤干性標記包括CD133,CD44,LGR5和EpCAM,WB檢測了CBX8對腫瘤肝性標記表達調控作用。敲低CBX8顯著降低CC細胞中CD133,LGR5,CD44和EpCAM的表達,過表達CBX8顯著增加了CC細胞中干性標志物的表達。流式檢測到敲低CBX8的CC細胞減少細胞中LGR5高表達的比例,過表達結果相反。皮下成瘤實驗中,注射了敲低CBX8基因DLD-1和LoVo細胞的小鼠的腫瘤發病率明顯降低。成球實驗表明,LGR5+細胞比LGR5-細胞表現出更強的成球能力。LGR5+細胞有助于小鼠的腫瘤形成,并表現出較強的抗細胞凋亡的能力(通過L-OHP或CPT-11誘導)。
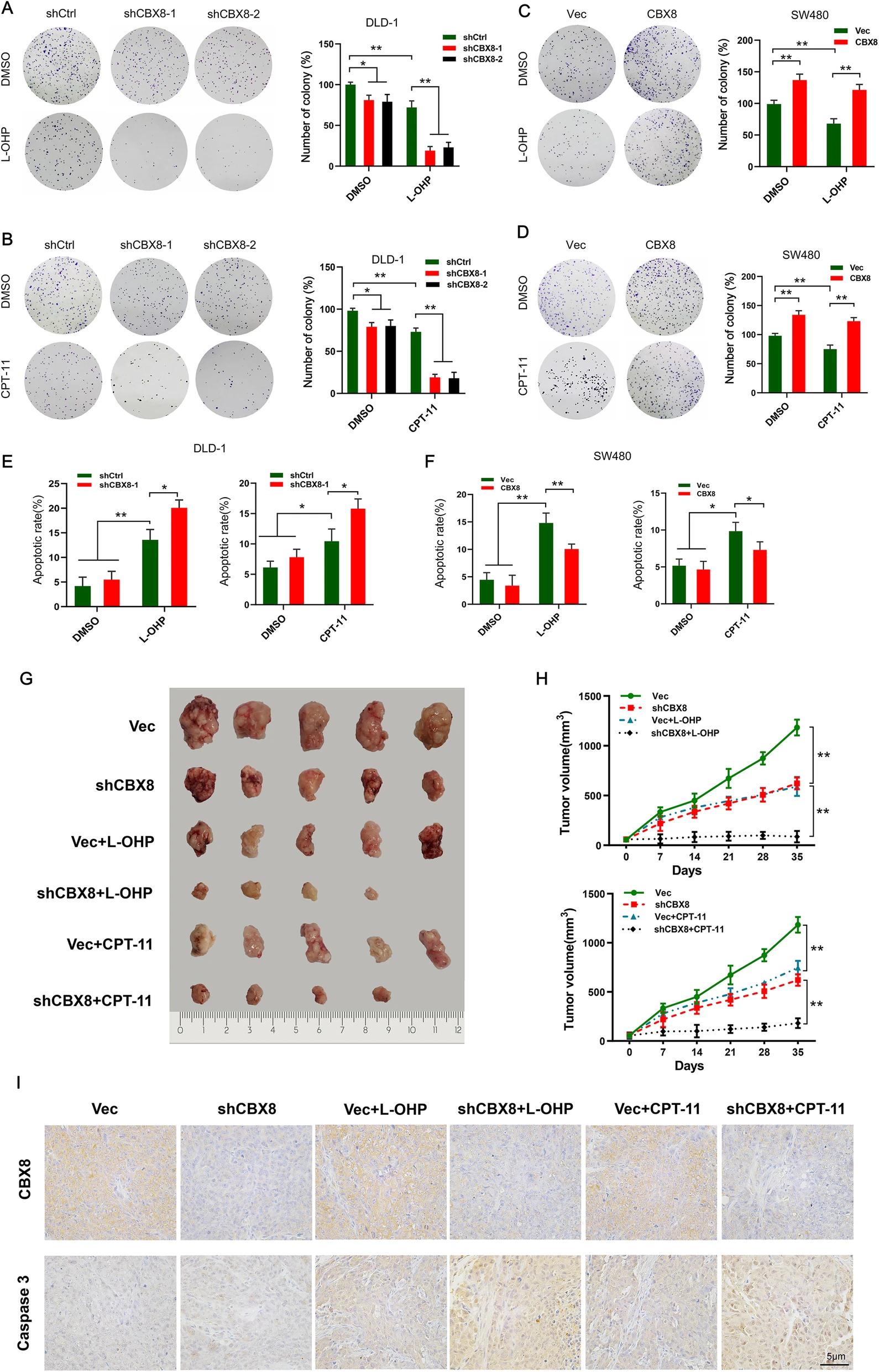
二、CBX8抑制CC細胞對L-OHP和CPT-11的化療敏感性
由于敲低CBX8抑制CC細胞的干性,接下來檢查CBX8是否會影響CC細胞的化療敏感性。敲低CBX8的CC細胞在L-OHP和CPT-11處理下,表現出較差的集落形成能力和較高的細胞凋亡率。過表達CBX8后,結果相反。結果表明,CBX8敲低或過度表達與化療藥物有協同作用。為了進一步研究CBX8敲低是否影響化療敏感性,通過慢病毒干擾CBX8表達。結果表明,敲低CBX8表達可有效抑制腫瘤生長;shCBX8與L-OHP或CPT-11的結合對腫瘤生長的抑制作用比任何單獨的治療都要強。IHC結果確認了CBX8的表達被shCBX8干擾,并且shCBX8與L-OHP或CPT-11的組合促進了細胞凋亡。綜上所述,這些數據表明病毒介導的CBX8沉默增加了CC細胞對L-OHP和CPT-11的化療敏感性。
三、LGR5為CBX8的靶標并介導CBX8誘導的CC細胞干性
通過轉錄組測序確定干擾CBX8和對照細胞的mRNA表達譜。敲低CBX8導致2234個基因的上調和3410個基因的下調。GSEA分析結果表明,差異表達的基因集顯著與癌癥干性和侵襲相關。使用ChIP-seq方法確定了CC細胞中CBX8的全基因組靶位,CBX8優先分布在基因的轉錄起始位點(TSS)附近。GO)分析結果表明,CBX8結合基因的最重要生物學功能包括轉錄的正調控,Pol II調控區序列特異性DNA結合和轉錄corepressor活性。分析了敲除CBX8后差異表達基因與ChIP-seq數據之間的重疊基因集,發現46個上調基因包含在CBX8目標基因集中,而83個下調基因包含在CBX8目標集中基因。重要的是,LGR5位于83個下調的靶基因中,因此推測CBX8可以參與調控LGR5。
為了進一步評估LGR5對CBX8介導的干特性的影響,用LGR5過表達質粒轉染了CBX8敲低的CC細胞。LGR5的過表達恢復了CBX8耗盡誘導的干標記表達,球體形成能力和對L-OHP和CPT-11的化療敏感性的變化。相反,LGR5敲低挽救了CBX8過表達誘導的干性標記表達,球體形成能力和化療敏感性的變化。這些結果證實,CBX8可通過LGR5促進癌癥干并抑制化療敏感性。
四、CBX8通過以經典途徑與pol II相互作用調節LGR5轉錄
接下來,研究了CBX8促進LGR5表達的潛在機制。qRT-PCR的結果證實,敲低CBX8導致LGR5表達降低,而過表達CBX8導致LGR5表達升高,表明CBX8在轉錄水平上調節了LGR5表達。ChIP-seq結果表明,CBX8在LGR5的啟動子上富集。使用MEME來分析識別CBX8的結合基序,預測出五個高度相關結合序列,其中第四個基序中富含LGR5啟動子,可能在LGR5的轉錄調控中起關鍵作用。為了確定是否存在CBX8響應區域,構建了三個熒光素酶報告基因,其中包含LGR5啟動子的不同片段。螢光素酶報告基因分析的結果表明,CBX8敲低顯著降低了由-591/267片段驅動的螢光素酶活性;而CBX8過表達增強了由該片段驅動的螢光素酶活性。這些結果證實,CBX8啟動子的-591/267區含有CBX8響應位點。然后,我們構建了針對LGR5啟動子不同區域的七對引物。結合的ChIP和qPCR分析顯示,CBX8結合到CBX8啟動子中的區域2–5,該區域包括在-591 / 267個片段。Pol II抑制可抑制具有或不具有CBX8過表達的DLD-1細胞中的LGR5活化,ChIP-seq數據表明LGR5 啟動子中Pol II高度富集,CoIP分析結果表明CBX8結合了DLD-1細胞中的Pol II。敲低或過表達CBX8,并進行ChIP-PCR分析。結果顯示,敲低CBX8時,CBS2和CBS4上Pol II的占用率降低。相反,在CBX8過表達后,發現Pol II在CBS2和CBS4處的占用增加。作者還研究了CBX8是否以經典的PRC1依賴性方式促進LGR5轉錄。為此,敲低DLD-1細胞中Ring1b的表達,但Ring1b的敲低并未干擾LGR5的表達,這表明CBX8介導的LGR5激活不涉及PRC1的經典機制。

五、CBX8通過與KMT2b結合而在LGR5啟動子上維持H3K4me3
為了深入了解CBX8調控LGR5表達的機制,使用UCSC確定是否存在組蛋白修飾(H3K4me3、H3K27me、3H3K27Ac)。H3K4me3和H3K27Ac標記轉錄激活,而H3K27me3標記轉錄抑制。結果發現高富集的H3K4me3和H3K27me3的峰重疊。ChIP分析用于進一步確定CBX8是否通過組蛋白修飾調節LGR5。在LGR5啟動子處,CBX8的敲低和過表達分別降低和增加了H3K4me3的表達,而CBX8敲低并沒有改變H3K27me3或H3K27Ac的表達。這些數據暗示在LGR5啟動子上的H3K4me3修飾是CBX8介導的LGR5激活的原因。來自ENCODE的ChIP-seq數據顯示KMT2b富含LGR5啟動子,干擾KMT2b不會降低LGR5表達。WB結果顯示,過表達CBX8并敲低KMT2b-抑制LGR5活化。此外,CoIP檢測結果顯示CBX8在DLD-1細胞中與KMT2b相互作用。當這些標記的蛋白在HEK293細胞中共表達時,CoIP鑒定了CBX8和KMT2b之間的相互作用。為了進一步評估KMT2b在CBX8介導的LGR5表達中的作用,我們通過ChIP-qPCR重新檢查了LGR5啟動子的七個區域,ChIP分析表明,KMT2b在區域3、5和6中顯著富集。敲低CBX8降低了KBS1和KBS2處KMT2b的結合率,而KMT2b耗盡抑制了KBS1和KBS2處KMT2b和H3K4me3的富集。這些結果表明,CBX8導致KBS1和KBS2處的KMT2b積累,以維持H3K4me3修飾狀態。為了進一步確認KBS1和KBS2是否是促進LGR5表達的關鍵位點,我們構建了幾種螢光素酶報告基因質粒,該質粒包含帶有或不帶有KBS1和KBS2突變的各種啟動子區域。當KBS1或KBS2發生突變或KBS2被刪除時,CBX8基因敲除和過表達分別降低和增加報告基因活性。在LGR5啟動子中構建了KBS1突變和KBS2缺失的質粒,發現CBX8的敲除和過表達都不會影響報告基因的活性。這些結果表明,在CC細胞中,CBX8將KMT2b募集到KBS1和KBS2,從而通過H3K4me3促進LGR5轉錄。
為了鑒定CBX8與KMT2b結合的結合域,我們克隆了5個帶有Flag標簽的CBX8構建體,并用截短的質粒轉染了DLD-1細胞。用抗-Flag抗體對細胞提取物進行IP。Flag-CB4與癌細胞中的KMT2b相互作用,表明與KMT2b相互作用需要CBX8氨基酸214和300之間的結構域。

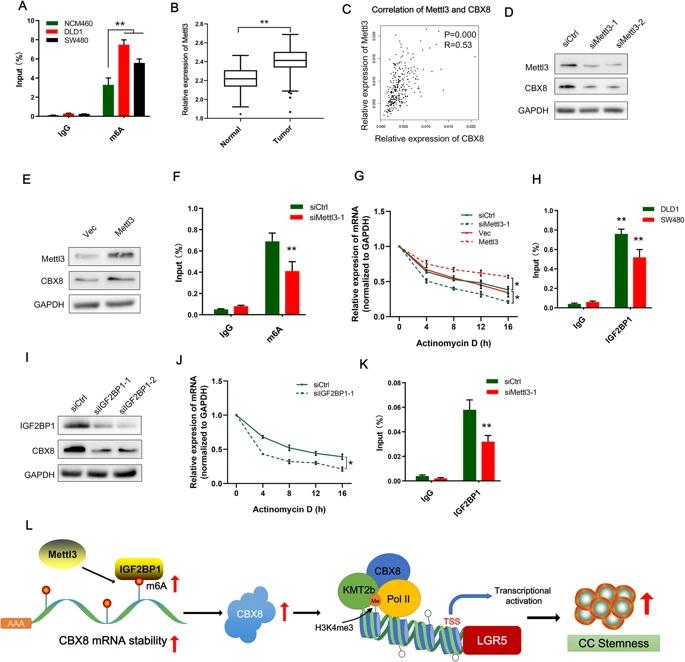
六、Mettl3誘導的m 6 A修飾參與CBX8的上調
導致CBX8異常表達的機制尚不清楚。RMBase預測顯示,許多高度可信的m6A位點分布在CBX8 mRNA中,因此推測CBX8的上調是否依賴于m6A修飾。MeRIP與qRT-PCR結合顯示,DLD-1和SW480細胞中m6A的富集程度明顯高于正常NCM460細胞。TCGA數據庫中評估了Mettl3表達以及Mettl3和CBX8表達之間的相關性。值得注意的是,Mettl3在CC組織中顯著上調,并且Mettl3表達與CBX8表達正相關。敲低Mettl3明顯降低了CBX8 mRNA和蛋白質水平,相反,過表達Mettl3增加了CBX8的mRNA和蛋白質表達水平。MeRIP PCR也表明,敲低Mettl3降低CBX8 mRNA的m6A甲基化水平。敲低Mettl3導致CBX8 mRNA的穩定性降低,而Mettl3過表達則可以提高CBX8 mRNA的穩定性。這些結果揭示了Mettl3通過促進CC細胞中的m6A修飾來維持CBX8 mRNA的穩定性。
使用RMBase 預測了CBX8 m 6 A位點的潛在讀者,發現IGF2BP1確實在CBX8 mRNA上具有結合位點。RIP分析證實了CC細胞中IGF2BP1和CBX8 mRNA之間存在直接相互作用,敲低IGF2BP1會顯著降低CBX8蛋白表達水平。敲低IGF2BP1后,CBX8 mRNA的中位半衰期明顯縮短;敲低Mettl3后,IGF2BP1和CBX8 mRNA之間的相互作用受到損害。這些數據表明,IGF2BP1與CBX6 mRNA結合,以m6A依賴的方式增強其穩定性。
七、CC中Mettl3 / CBX8 / LGR5軸的臨床意義
qRT-PCR和WB驗證臨床CC樣本中CBX8表達,IHC結果證實高表達CBX8主要定位于在CC組織細胞核。化學抗性CC組織中的CBX8表達高于化學敏感的CC組織。數據庫分一下預后相關性和生存曲線。IHC結果顯示,化療抗性患者CBX8,Mettl3,LGR5,CD133和CD44表達水平較高。
最后今天就看到這里,下回帶大家看點別的,再見!!






