mregDCs,新的DCs亞群
樹突狀細胞(Dendritic cells, DC)是機體功能最強的專職抗原遞呈細胞,它能高效地攝取、加工處理和遞呈抗原,未成熟DC具有較強的遷移能力,成熟DC能有效激活初始T細胞,處于啟動、調控、并維持免疫應答的中心環節。然而,在機體內腫瘤塑造的免疫抑制性環境會導致DCs的功能異常,阻礙正常的抗腫瘤免疫反應。最近,美國紐約州西奈山伊坎醫學院的Miriam Merad教授及其研究團隊發現,一種傳統的樹突狀細胞調控會限制機體的抗腫瘤免疫,從而影響腫瘤發展。相關研究結果以“A conserved dendritic-cell regulatory program limits antitumour immunity”為題發表在Nature雜志上,雜志影響因子42.778。

研究思路:
結果:
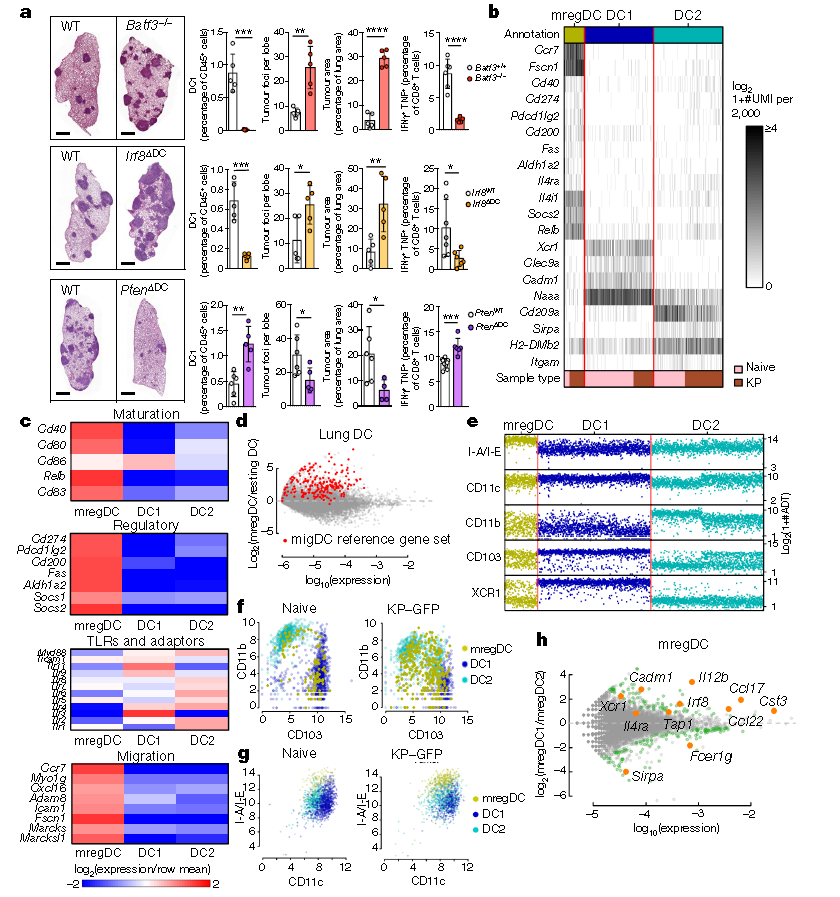
1.DC1s在腫瘤進展中的作用
作者建立了全身DC1s缺陷型Batf3-/-小鼠(Baft3是調控樹突狀細胞亞群分化的關鍵性轉錄因子)模型、肺特異DC1s缺陷型的Irf8ΔDC小鼠(Irf8的缺失會導致DCs不能發育成熟)模型和肺特異DC1s增加的PtenΔDC小鼠(Pten的缺失會導致體內DCs數量的增加)模型,發現與對照組相比,Batf3-/-和Irf8ΔDC兩組小鼠顯示出更多的腫瘤病灶,且TNF+IFNγ+CD8+T細胞的數量減少,而PtenΔDC小鼠肺中DC1s數量增加三倍,病灶明顯減少,同時TNF+IFNγ+CD8+T細胞的比例也顯著高于對照組,表明DC1s能抑制腫瘤發展(a)。利用單細胞測序技術對肺癌組織和癌旁組織中的MHC II+CD11c+細胞譜進行分析,發現有三群細胞表達典型的DCs標記(b),其中一群DCs表達一系列成熟標記物及免疫調節基因(定義為mregDCs)(c)。進一步對lin-MHC II+CD11c+DCs進行了CITE-seq分析發現DC1s和DC2s的亞型都表達了mregDCs信號且mregDCs表達高水平的MHC Ⅱ類蛋白(e-g),而CD103+CD11b-mregDCs(mregDC1s)表達較高水平的Il12b、Ccl17、Irf8和Cadm1,而CD103-CD11b+mregDCs(mregDC2s)表達較高水平的Sirpa和Fcer1g(h)。以上結果說明缺乏DC1s會促進腫瘤發展。
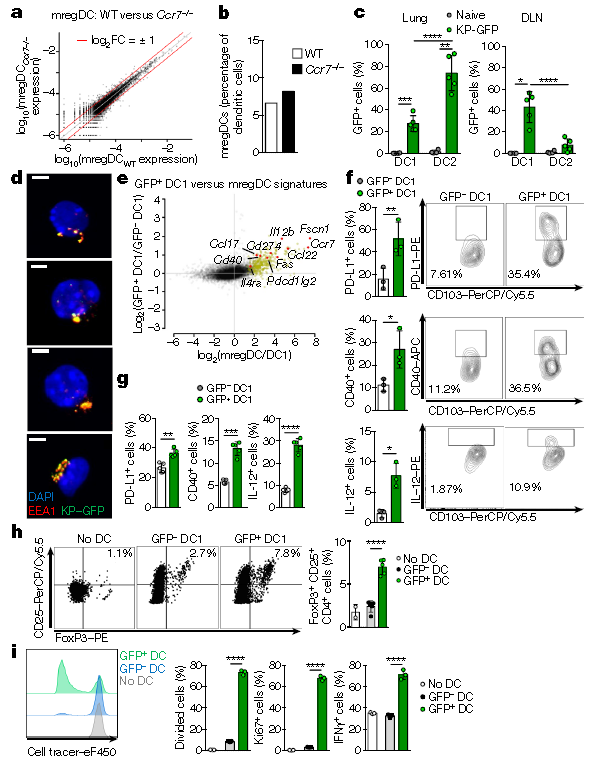
2.mregDC1s調控機制
作者構建Ccr7-/-小鼠模型,發現Ccr7-/-小鼠(介導免疫細胞歸巢至淋巴器官)的mregDCs并未受到影響(a,b)。通過向小鼠中注射表達綠色熒光蛋白的KP腫瘤細胞,發現在引流淋巴結(DLNs)中,只有DC1s檢測到了GFP(c),熒光共定位顯示腫瘤抗原在早期核內體被DC1s內化并保持完整(d)。對KP-GFP小鼠肺的GFP+DC1s和GFP-DC1s進行測序分析顯示mregDCs基因在GFP+腔室富集(e)。通過流式細胞術發現 GFP+DC1s和DC2s上調許多mregDCs轉錄簇蛋白產物,包括PD-L1、CD40和IL-12(f),利用骨髓來源的DC1s,發現在體外捕獲凋亡的KP-GFP腫瘤細胞時,DC1s上調了PD-L1、CD40和IL-12的表達(g),這表明腫瘤細胞相關抗原的攝取與DC1中mregDC的誘導有關。同時,帶腫瘤抗原的GFP+DC1s比GFP-DC1s更能有效促進原始T細胞向調節性T細胞分化(h),將腫瘤病灶中的GFP+mregDC1s與具有GFP特異性T細胞抗原受體的JEDI T細胞進行共培養,發現GFP+mregDC1s在體外能促進CD8+JEDI T細胞的激活(i),表明DC1s誘導CD8+ T細胞抗原特異性反應的能力以及mregDCs的雙重調節和免疫原性。
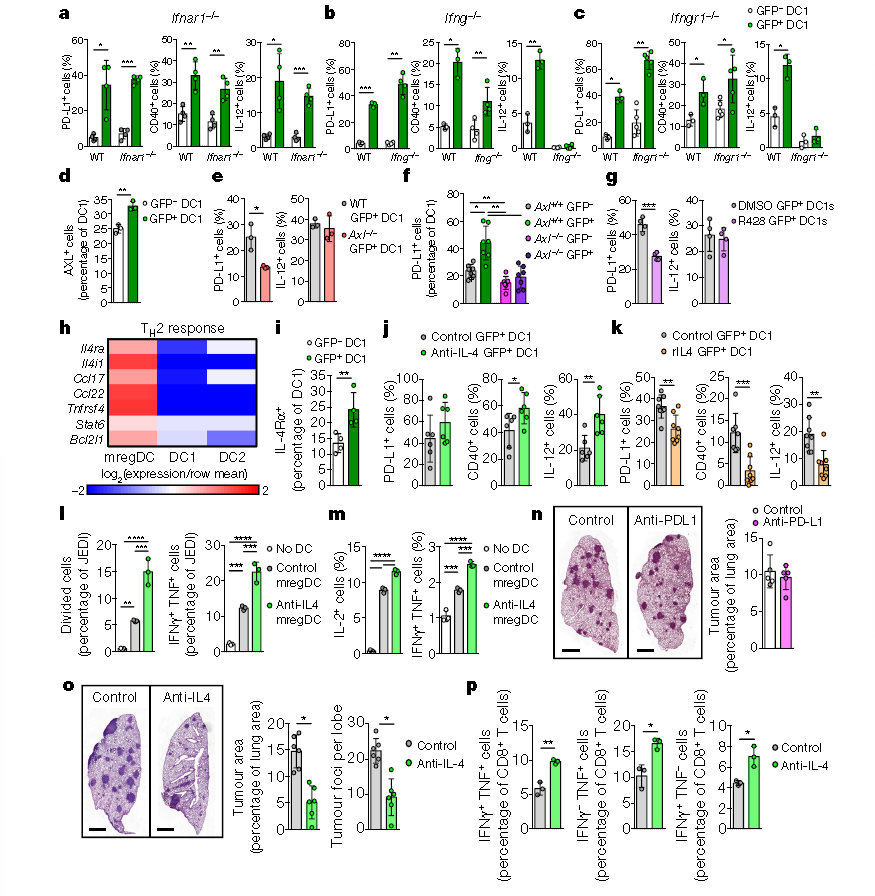
3.mregDC調控驅動因素
為了進一步探究mregDC調控驅動因素,通過流式細胞術發現發現缺乏I型和II型干擾素信號并不能抑制PD-L1的上調(a-c),且在DC1s中IFN-γ是IL-12的主要驅動因素,當Ifng或Ifngr1缺失,在體內基線或體內腫瘤抗原攝取時,DC1s可消除IL-12的產生(b,c)。單細胞RNA測序實驗和體內體外實驗表明Axl是少數在mregDC1s中表達的吞噬細胞表面受體之一(d),且能調節腫瘤細胞中PD-L1的表達,并會在病灶中富集抵抗免疫治療,但并不能調節DC1s產生IL-12(e-g)。利用流式細胞術發現在腫瘤DC1s中發現IL-4Rα蛋白水平升高,在荷瘤小鼠中使用IL-4阻斷抗體,在不影響PD-L1水平的情況下(i),與使用同型對照抗體的小鼠相比,肺部產生IL-12的DC1s數量增加了一倍(j)。重組IL-4直接作用于骨髓來源的DC1s,在捕獲凋亡的KP-GFP細胞時減少IL-12的產生,顯示IL-4可以直接調節DC1功能(k)。同時,比較IL-4阻斷抗體處理的GFP+mregDC1s與用同型抗體處理的GFP+mregDC1s,發現用阻斷抗體處理后更能激活JEDI CD8+ T細胞(l)。表達卵蛋白特異性TCR (OT-II細胞)的CD4+ T細胞,經IL-4阻斷抗體和卵蛋白肽脈沖處理的小鼠的mregDCs,與對照組(卵蛋白肽脈沖激活OT-II細胞mregDCs)相比,細胞因子水平升高(m)。IL-4阻斷抗體降低了抗PD-L1封鎖的KP-GFP病變的生長(n,o),且能增加腫瘤中IFNγ+TNF+CD8+T細胞的數量(p)。這些結果表明,在體內mregDC產生過程中阻斷IL-4可以增強mregDC的免疫原性和T細胞效應功能。
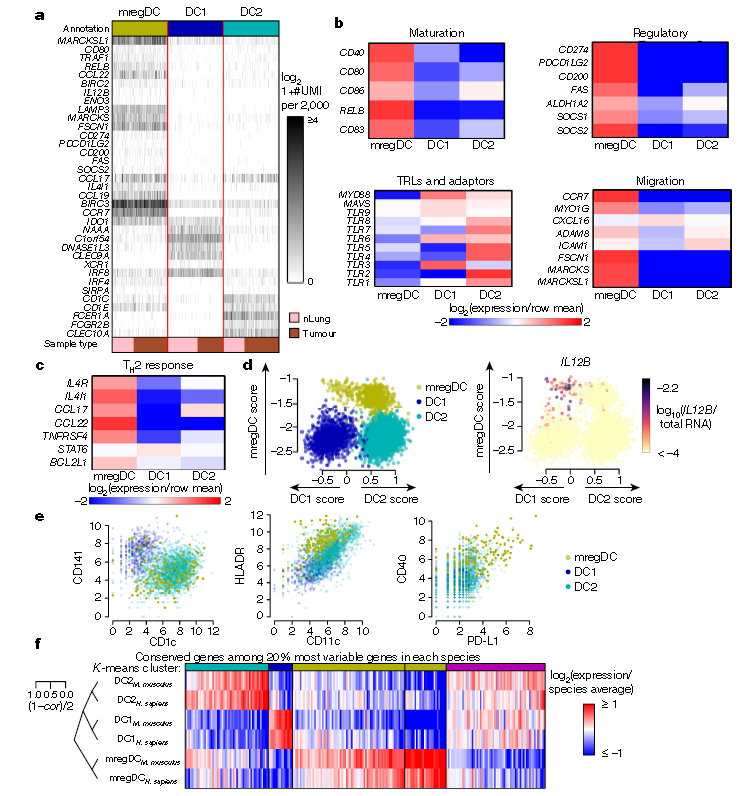
4、mregDC1s在人腫瘤發展中的作用
為了進一步研究mregDC1s在人腫瘤發展中的作用,利用單細胞測序技術分析了非小細胞肺癌組織和正常肺組織的細胞,發現了DC1s/DC2s/mregDCs,且mregDCs表達高水平的TH2應答基因IL4R、IL4I1、CCL17、CCL22和BCL2L1(a-c)。使用DC1和DC2基因評分對mregDCs進行分層,確定了mregDC1和mregDC2亞群,且IL-12B的表達對人的mregDC1s是特異的(d)。CITE-seq分析結果顯示DC1s和DC2參與mregDCs(e),且mregDC在人家和小鼠中是保守的(f)。
參考文獻:
Barbara Maie, Andrew M. Leader, Steven T. Chen, et al. A conserved dendritic-cell regulatory program limits antitumour immunity. Nature, 2020;






