開發出治療帕金森病新策略!包覆基因-化學納米復合物的外泌體可以清除α突觸核蛋白和激活帕金森病免疫

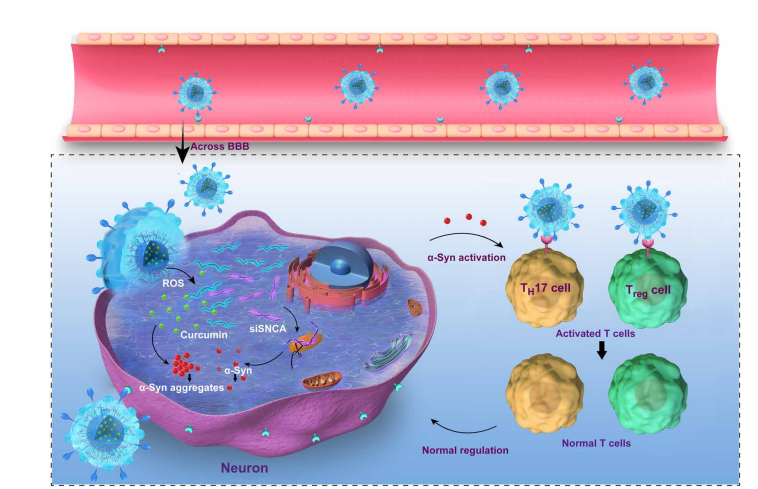
2020年12月,來自中國科學院過程工程研究所生化工程國家重點實驗室、中國科學院大學與北京理工大學生物工程學院團隊合作在Science advance雜志上發表了文章“Targeted exosome coating gene-chem nanocomplex as "nanoscavenger" for clearing α-synuclein and immune activation of Parkinson's disease.”。此文獻描述了一個工程核-殼雜交系統,名為狂犬病毒糖蛋白(RVG)肽修飾的外泌體(EXO) curcumin/苯基硼酸-聚(2-(二甲氨基)丙烯酸乙酯)納米粒子/靶向SNCA (REXO-C/ANP/S)的小干擾RNA。它是一種清除-突觸核蛋白聚集物并降低其在帕金森病神經元中的細胞毒性的納米清除劑。經REXO-C/ANP/ s治療后,帕金森病小鼠的運動行為得到顯著改善。團隊也證明REXO-C/ANP/S是一種清除免疫激活的納米清除劑,因為其天然不成熟的樹突狀細胞外膜。總之,REXO-C/ANP/S可作為神經退行性疾病的治療平臺。
對于神經退行性疾病,可以利用基因和小分子藥物協同清除引起神經元變性的病理物質。
在帕金森病(Parkinson s disease, PD)中,α突觸核蛋白 (α-syn)聚集物被認為是主要的病理物質。siRNA在罕見疾病或沒有良好藥物選擇的疾病中表現出潛力,但與基因相關。例如,針對SNCA的siRNA (siSNCA)可以通過下調α-syn蛋白的合成來抑制α-syn聚集物的形成。神經保護小分子藥物姜黃素對已有的α-syn聚集物具有降低作用。因此,siSNCA與姜黃素聯合可以協同降低α-syn聚集物對PD治療多巴胺能神經元的細胞毒性。然而,因為它們的吸收能力差,新陳代謝快,這些生物利用度較差的藥物難以在靶神經元的作用部位聚集。此外,腦輸送問題主要表現為輸送系統難以通過血腦屏障(BBB),不能準確識別靶細胞。
合成基因和化學藥物(gene-chem)納米復合物,包括脂質體和聚合物顆粒,已被修飾為細胞穿透多肽或細胞靶向分子,以增強藥物輸送在腦疾病或其他疾病的治療。然而,合成的納米復合物容易被識別為外來物,導致自然免疫激活、細胞凋亡、血液循環時間短,不安全且效率低。此外,當這些合成載體被內化時,會經歷一個內溶酶體途徑,這往往導致藥物降解和胞外作用,并導致炎性小體激活。此外,有必要控制藥物在病變區域的釋放,以減少非特異性毒性。因此,為了有效地將基因化學藥物遞送到靶細胞的作用部位以實現PD的安全治療,有必要開發一種能夠克服這些遞送瓶頸的遞送系統,包括低血腦屏障通透性、神經元靶向性差、胞漿內吞效率低下和藥物釋放不可控等。
為了實現上述目標,作者設計了一種靶向外泌體涂層基因-化學納米復合物,作為神經元α-syn聚集物和PD免疫激活的工程納米清除劑。外泌體是一種經過充分研究的siRNA和化學藥物的天然源載體,直徑為30至100納米。它具有一種膜結構,其表面特異性蛋白四asppanin CD9促進直接膜融合,并幫助內部物質直接運輸到受體細胞的細胞質中,避免了溶酶體誘捕。
進一步有效地提供藥物通過BBB和多巴胺能神經元,第一個過程的工程是構建殼,REXO一種靶向的未成熟樹突狀細胞(imDC)衍生的外泌體,該外泌體由狂犬病毒糖蛋白(RVG)肽修飾而成,具有29個氨基酸,能特異性結合神經元細胞和BBB表達的乙酰膽堿受體。由于外泌體很難同時裝載親水基因和疏水小分子藥物,工程的第二個過程是作為一個基因-化學包覆核心的產品實現的,這是一個響應活性氧(ROS)的基因化學藥物納米復合物裝載這兩種不同特性的藥物。第三種工藝是REXO-C/ANP/S納米清除劑的制備。REXO被涂在納米復合物上形成納米清除劑。因此,該工程傳遞系統能夠有效穿過血腦屏障,靶向神經元,并在多巴胺能神經元病變的高ROS環境中釋放藥物。富集的siSNCA和姜黃素對α-syn蛋白下調和α-syn聚集抑制具有協同作用。
技術路線:
一、REXO-C/ANP/S的制備方法及表征
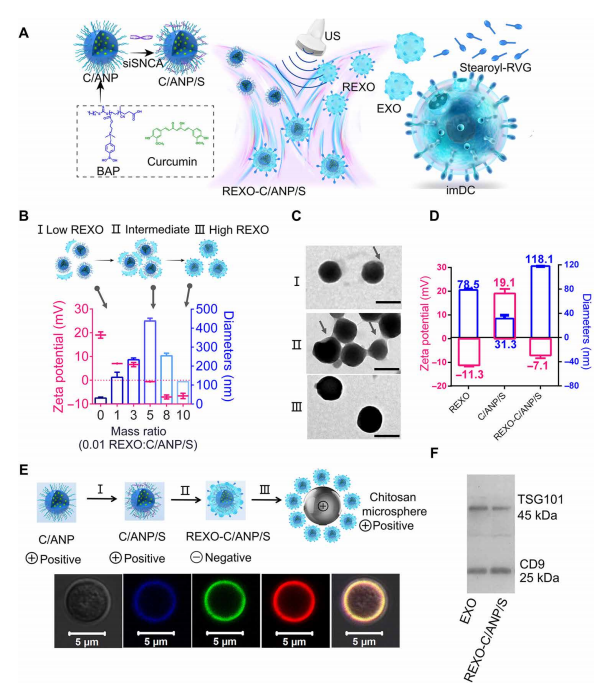
雜化納米粒子(NP) REXO-C/ANP/S的制備由兩部分組成(圖1A):基因化學核心C/ANP/S的制備和REXO的獲取。核心C/ANP/S是通過兩步法得到的。首先,我們合成了聚合物ba -聚(2-(二甲氨基)丙烯酸乙酯)(BAP)和bb -聚(2-(二甲氨基)丙烯酸乙酯)(BBP)(圖S1A)。
核磁共振H表明BAP和BBP合成成功(圖S1, B到D)。兩親性聚合物BAP可自組裝并包封疏水性藥物姜黃素,形成姜黃素/BAP NP (C/ANP)。采用Multiskan光譜法計算姜黃素在NP中的加載率,加載率為70%。接下來,通過靜電相互作用形成最終的C/ANP/siSNCA (C/ANP/S)和C/BNP/siSNCA (C/BNP/S)納米配合物(圖1A)。隨后運用gel retardation assay,現siSNCA完全附著在5的N/P(聚合物的氮部分/ siRNA的磷部分)C/ANP(圖S2A)。
第二部分是rvg修飾外泌體的制備REXO,使用頻率為40 kHz、功率為100 W的bath超聲器,通過超聲波方法組裝內芯和外部REXO(圖1A)。。
分離并收集含有外泌體的指定編號7,8,9的片段。通過透射電子顯微鏡(TEM)確定imDC外泌體為囊泡結構,水動力直徑約為70 nm, zeta電位為12.7 mV(圖2E)。
DiD外泌體與硬脂酰rvgfitc的共定位系數為0.95(圖S3E),表明RVG成功修飾外泌體。
組裝過程假設如圖1B所示,并通過TEM、尺寸和zeta電位測量進行驗證(圖1C)。
在REXO和C/ANP/S復合物中,在REXO-to-C/ANP/S質量比0.05以下,REXO吸附到C/ANP/S部分表面(圖1C, I)。
當NPs的質量比為0.01時,NPs的粒徑增加到141.0 nm, zeta電位下降到7.05 mV。當比值為0.05時,存在一個中間態。尺寸增大到437.5 nm, TEM顯示C/ANP/S通過REXO交聯(圖1C, II)。最后,負電荷占主導地位的NPs趨于穩定。
當質量比為0.1時,最終的核-殼單分散組裝形成如圖1C (III)所示,這表明REXO被涂覆在核納米配合物的表面。最終的NP REXO-C/ANP/S帶負電荷7.1 mV,流體動力直徑為118.1 nm(圖1D)。
接下來,為了便于直觀觀察組裝組分,制備了帶正電的聚殼聚糖微球,允許帶負電的組裝體在表面吸附(圖1E)。
外泌體用親脂性染料DiI標記。結果清楚地顯示了DiI外泌體、Cy5-siRNA和姜黃素的共定位(圖1E和圖S3F)。
此外,組裝后得到的REXO-C/ANP/S含有EXO的TSG101和CD9蛋白(圖1F),進一步表明包衣成功。
二、通過REXO涂層增強REXO- c /ANP/S的藥物傳遞
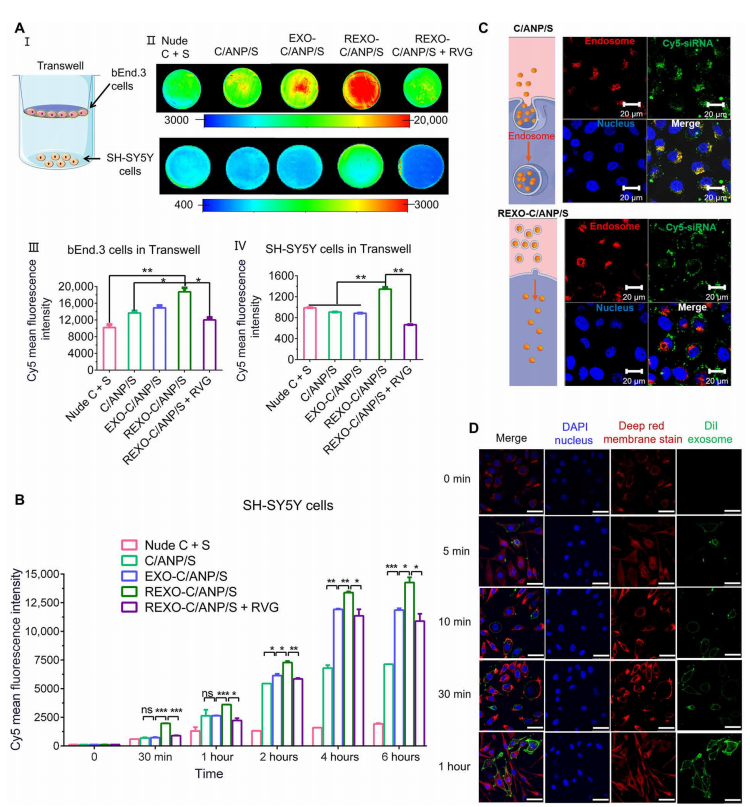
模擬REXO-C/ANP/S和C/ANP/S的體外給藥過程。我們使用Transwell培養法模擬血腦屏障(圖2A, I)。
bEnd.3細胞在Transwell插入物中培養7天(6孔中插入1x105個細胞,孔徑0.4 m, 4.67 cm2),形成單層細胞,經上皮電阻至少200歐姆·cm2。
加入NPs后,利用柯達體內成像系統FX Pro進行生物發光成像,檢測Cy5平均熒光強度。REXO涂層顯著增強了C/ANP/S中siRNA藥物進入bEnd.3細胞。然后通過上皮細胞分化為SH-SY5Y細胞(圖2A, II至IV)。作為比較,增加免費RVG肽抑制促進效應(圖2,II IV)。通過比較的siRNA SH-SY5Y細胞在不同時間點(圖2 b),發現REXO涂層顯著提高藥物的吸收在C / ANP / S。2小時后,EXO和REXO包衣組EXO-C/ANP/S和REXO-C/ANP/S顯著優于裸姜黃素和siRNA(裸C + S)以及內核C/ANP/S。這是因為C/ANP/S中的季胺類化合物通過核內體-溶酶體途徑將C/ANP/S內吞,造成NP外排和藥物損失,因此藥物積累隨著時間的增加并不明顯(圖2B)。
共聚焦激光掃描顯微鏡(CLSM)實驗結果比較了兩種體系的內吞機制(圖2C)。
隨著時間的延長,DiI的熒光增強,從5分鐘到1小時,明顯與深紅色膜染色的熒光共定位(圖2D和圖S4B)。
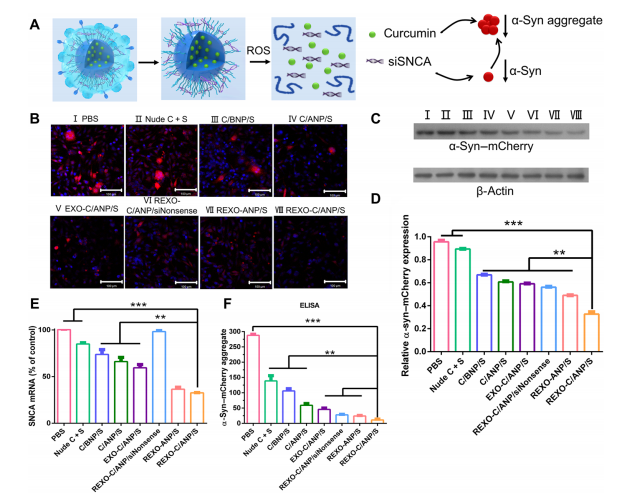
α-syn聚集物是PD神經元的主要病理物質。因此,清除PD處理中的α-syn聚集物和多余的-syn非常重要(圖3A)。
裸藥和不同NPs與SNCA mCherry SH-SY5Y細胞共培養2天。 CLSM觀察到-α-syn mCherry過表達細胞系中的α-syn聚集物,其中mCherry為α-syn的紅色報告因子(圖3B)。
Western blot也驗證了總α-syn表達[圖。3、C和D;47 kDa (α-syn為18 kDa, mCherry為29 kDa)]。
與無姜黃素的NP REXO-ANP/S和siNonsense NP REXO-C/ANP/siNonsense相比,REXO-C/ANP/S具有下調優勢。
此外,除REXO-C/ANP/ siNonsense處理的細胞外,np處理的細胞SNCA mRNA表達低于pbs處理的細胞。REXO-C/ANP/S處理后的細胞SNCA mRNA表達下降64%(圖3E)。此外,酶聯免疫吸附試驗(ELISA)顯示,NP用藥組處理的細胞中-syn聚集物顯著減少(圖3F)。
四、增強體內神經元恢復
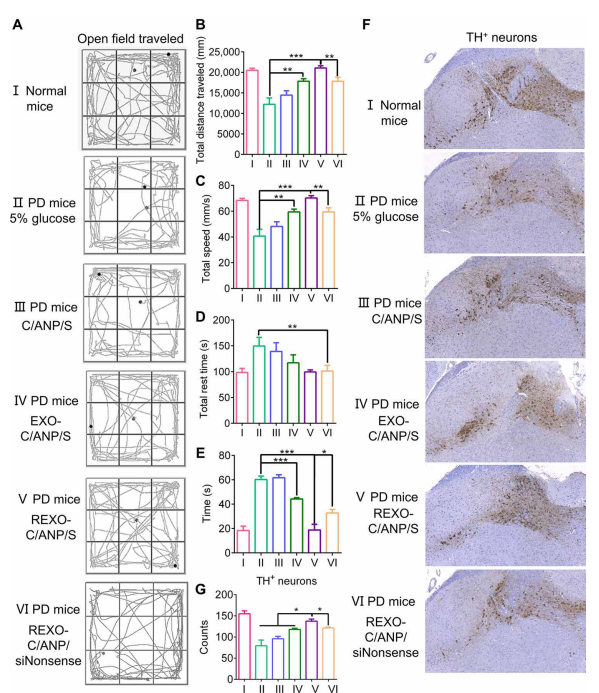
給藥10次后記錄行為。PD小鼠在開闊區域表現出運動遲緩,并且在中間區域行走較少(圖4A, II)。
在開闊場地進行30分鐘的定量數據顯示,它們的總距離減小,移動速度減慢,所需的休息時間變長[圖2]。4、B to D (II)。
NP組小鼠的運動能力有改善的趨勢,尤其是REXO-C/ANP/S組[圖4]。4、B到D (III到VI)]。
在極點實驗中,經過REXO-C/ANP/S處理后,到達桿尖的時間明顯縮短(圖4E)。
這種優勢在小鼠解剖后的大腦切片中也得到了體現。注射REXO-C/ANP/S的PD小鼠神經元修復效果優于其他各組(圖4,F和G)。
此外,蘇木精對np處理過的小鼠臟器載玻片染色表明其安全性,不會對小鼠肝臟或其他臟器造成負擔(圖S7)。
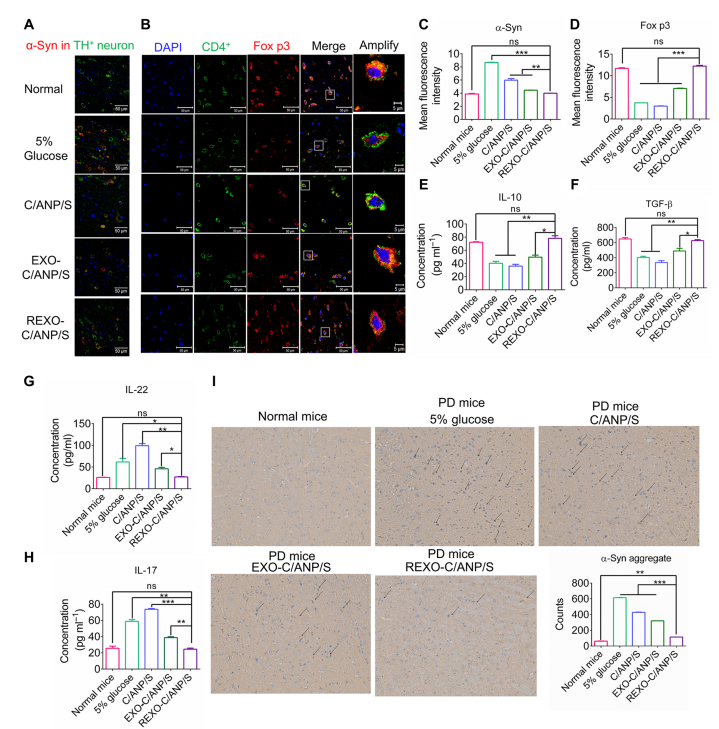
通過對處理小鼠SN區進行染色,我們得出協同載藥C/ANP/S納米復合物對TH+神經元α-syn有清除作用,但EXO-C/ANP/S和REXO-C/ANP/S的清除作用更明顯,特別是靶向NP REXO-C/ANP/S(圖5,a和C)。這是由于靶向外泌體優越的遞送優勢。此外,我們還探索了小鼠免疫微環境的改善。結果表明,imDC外泌體的作用可以清除PD小鼠的T細胞激活。在小鼠經NPs處理后,我們發現EXO-C/ANP/S,特別是REXO-C/ANP/S可以顯著增加CD4陽性(CD4+) T細胞中Fox p3的表達(圖5,B和D)。
此外,REXO-C/ANP/S可顯著增加PD中TGF-和IL-10(圖5,E, F)。已有研究證實TGF-信號具有抗炎作用,主要是神經保護作用。此外,IL-22和IL-17與自身免疫性疾病相關,并以免疫細胞因子的形式高表達。激活的TH17細胞分泌并產生IL-22和IL-17免疫細胞因子。結果表明,REXO-C/ANP/S可顯著降低PD中IL-22和IL-17因子(圖5,G和H)。






