腫瘤治療新技術——miR-101-3p納米藥物促進腫瘤鐵死亡
miR-101-3p可用于治療多種腫瘤的治療,但是它的抗腫瘤機制仍然未知,并且其用于體內腫瘤治療的確切策略也尚不可知。本研究探究了miR-101-3p對腫瘤細胞的抑制機制,并開發了相應的體內治療納米藥物。本文于2021年6月發表在《Redox Biology》IF:11.799期刊上。
技術路線:

主要的實驗結果:
1、miR-101-3p的表達在腫瘤細胞系和腫瘤組織中下降
作者檢測了6株肺癌細胞系A549,L78,NCI–H460,GLC-82,SPC-A1,PC9和一株人上皮細胞系BEAS-2B中miR-101-3p的表達,結果顯示與BEAS-2B相比,miR-101-3p的表達在肺癌細胞系中顯著低表達。隨后檢測了32個肺癌組織(LC)樣本和同源相鄰正常組織(ANT)樣本中的表達,結果顯示與ANT相比,在LC中顯著低表達。隨后將32例LC樣本根據腫瘤大小分為兩組,結果發現miR-101-3p在腫瘤體積大的樣本中的表達要顯著低于腫瘤體積小的。這些結果表明miR-101-3p的表達在腫瘤細胞系和腫瘤組織中下調。
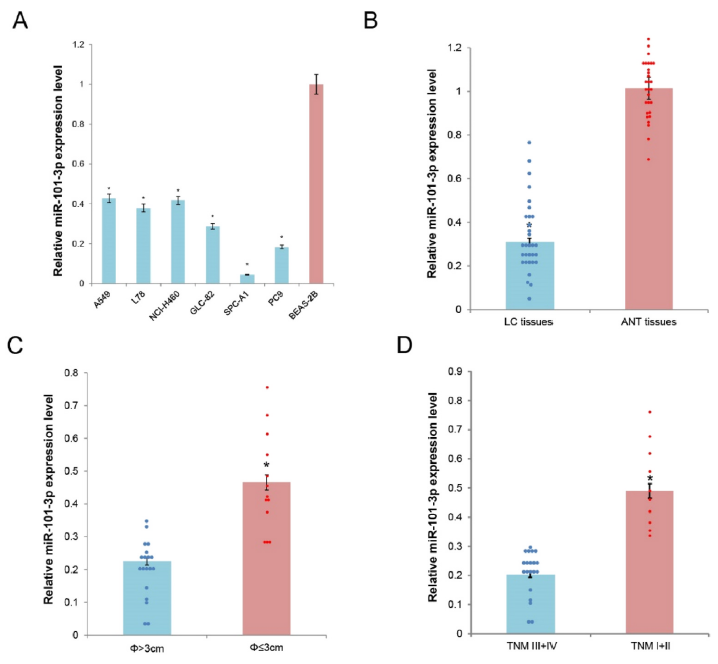
圖1 miR-101-3p的表達在腫瘤細胞系和腫瘤組織中降低
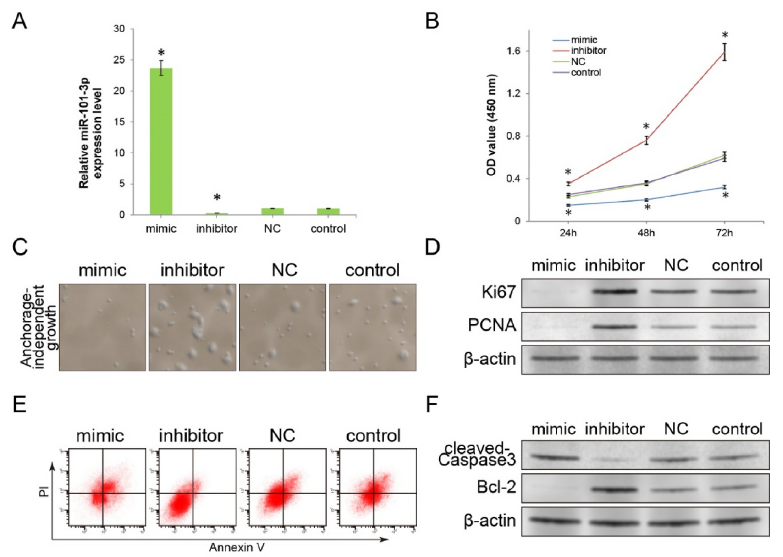
2、促進miR-101-3p的表達抑制腫瘤細胞的生長并增強凋亡
為了進一步探頭miR-101-3p對腫瘤細胞生物學功能的影響,構建了miR-101-3p過表達和miR-101-3p表達抑制的細胞系,如圖2A所示。隨后,CCK8,流式和WB等實驗證實,過表達miR-101-3p會抑制細胞的增殖和生長,并抑制Ki67和PCNA的表達,但會增強細胞的凋亡比例,以及增加cleaved-Caspase3的表達減少Bcl-2的表達。相反地,抑制miR-101-3p的表達會促進腫瘤細胞的增殖并減少細胞凋亡。以上結果表明miR-101-3p在腫瘤增殖和凋亡中發揮了重要作用。
3、miR-101-3p抑制腫瘤細胞通過靶向TBLR1
生物信息學預測分析顯示miR-101-3p在TBLR1的3’UTR區域存在3個結合位點(圖3A)。作者此前的研究結果表明TBLR1是一個肝癌和宮頸癌的原癌基因,也有證據顯示其也是肺癌中的原癌基因。因此,探討了miR-101-3p和TBLR1的表達相關性,結果顯示在32例LC樣本中它們的表達負相關。熒光素酶實驗結果顯示miR-101-3p mimics和TBLR1野生型共轉染時熒光素酶活性顯著下降,而和TBLR1突變型共轉染時沒有顯著改變,表明miR-101-3p和TBLR1之間存在結合關系。進一步地,WB結果顯示,過表達miR-101-3p后TBLR1的表達顯著下降,抑制miR-101-3p的表達則促進TBLR1的表達。這些結果表明,miR-101-3p可能通過結合TBLR1的3'UTR區域直接控制TBLR1的表達水平。
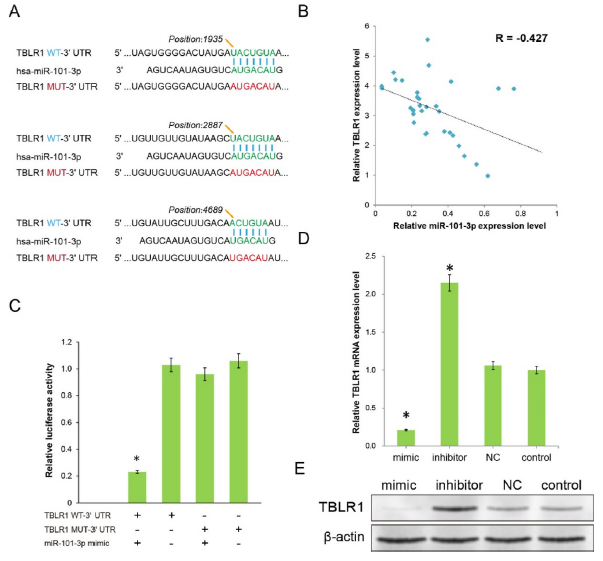
圖3 初步探索miR-101-3p產生治療作用的靶點
為了進一步探究miR-101-3p作用于腫瘤細胞生長和凋亡的作用是否是通過調節TBLR1的表達,作者進行了回復實驗。如圖4所示,單獨轉染TBRL1過表達載體,會顯著上調TBLR1的蛋白表達,減少腫瘤細胞凋亡,促進腫瘤細胞的增殖和Bcl-2的表達,而同時供轉染TBRL1過表達載體和miR-101-3p mimics則會顯著抵消上述作用。表明miR-101-3p作用于腫瘤細胞生長和凋亡的作用是通過調節TBLR1的表達。

圖4 miR-101-3p靶點產生治療作用的體外功能驗證
4、miR-101-3p/TBLR1軸調節鐵死亡并可作為腫瘤治療的潛在靶點
通常,癌細胞的突變會顯著阻礙細胞凋亡的激活。因此,探索了miR-101-3p /TBLR1軸激活凋亡進而抑制增殖的分子機制。作者此前的研究表明TBLR1會顯著抑制NF-kB通路的活性。據報道,NF-kB通路可以通過GPX4或PTGS2調節腫瘤細胞的鐵死亡。因此,作者探究了miR-101-3p/TBLR1軸對鐵死亡的影響。共聚焦顯微鏡顯示miR-101-3p過表達后細胞中總體ROS水平顯著增加,GPX4的表達顯著下降,PTGS2的表達顯著增高,脂質ROS水平也顯著增加,而GSH水平則顯著下降。而抑制miR-101-3p則上述結果相反。因此,這些結果表明miR-101-3p可調節腫瘤細胞鐵死亡。
此外,miR-101-3p mimics和TBLR1過表達載體共轉染會顯著反轉上述miR-101-3p mimics單獨處理帶來的改變,表明miR-101-3p/TBLR1軸可以共同調節腫瘤細胞鐵死亡進而貢獻腫瘤進展。
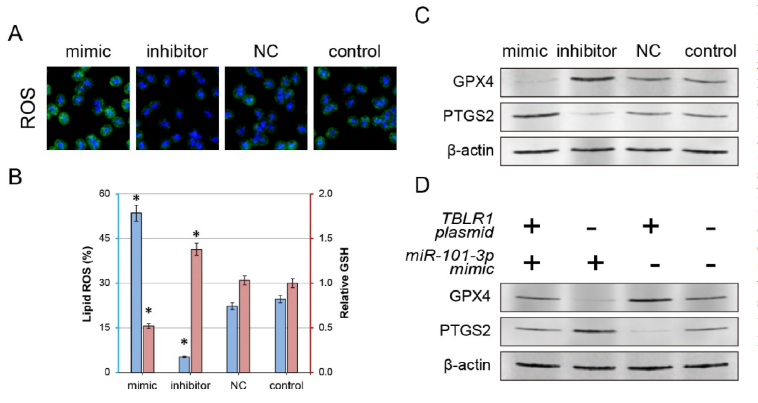
圖5 miR-101-3p/TBLR1軸是因鐵死亡調節而產生的抗腫瘤作用
納米基因載體可以形成納米級藥物攜帶治療性的核酸,其可保證治療性核酸在體內治療時的穩定性,進而通過增強通透性和滯留效應實現腫瘤組織分布。作者嘗試構建納米基因傳遞和miR-101-3p的基因治療用于體內腫瘤治療。作者用紅色熒光POPO3標記miR-101-3p,如圖6A所示,納米載體組紅色熒光顯著增強,而單獨熒光質粒組則很難部分至細胞中。使用NIFR,CY7染色納米載體后,將其通過尾靜脈注射至小鼠體內,觀察到納米載體在腫瘤區域的顯著聚集分布(圖6B)。隨后收集這些腫瘤組織進行病理觀察,如圖6C所示,與對照組相比,納米載體組的腫瘤細胞中觀察到顯著的熒光聚集。該體外實驗結果直接證明了體內熒光染色觀察到的納米載體在腫瘤區域的聚集。總之,上述研究表明,納米載體可以有效地將質粒攜帶到腫瘤區域,從而促進腫瘤細胞的體內轉染。
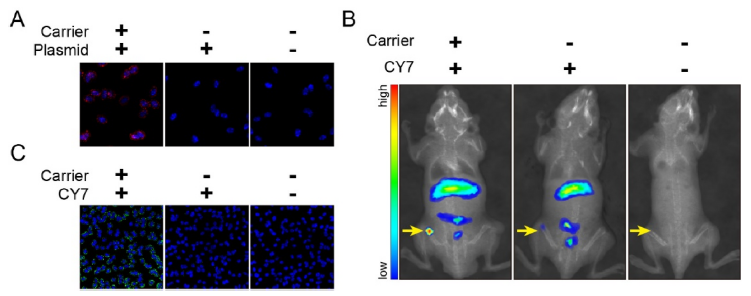
圖6分子成像追蹤技術研究納米載體靶向腫瘤鐵死亡進行體內治療的可能性
6、miR-101-3p的納米載體抑制腫瘤生長
基于上述研究事實,作者專注于利用這種納米載體來攜帶miR-101-3p mimics,并在體內腫瘤治療實驗中探究其治療效果。將腫瘤細胞皮下注射到裸鼠體內,處理4周,然后用含有miR-101-3p mimic、miR- 101-3p inhibitor或NC的納米載體通過尾靜脈注射給裸鼠治療。如圖7A和7B所示,裝載miR-101-3p mimic的納米載體顯著抑制了腫瘤的生長和體積,而裝載miR-101-3p inhibitor的納米載體則顯著促進了腫瘤的生長和體積。此外,miR-101-3p的表達支持了上述結果,在miR-101-3p mimic的納米載體組上調,在miR-101-3p inhibitor的納米載體組下調(圖7C)。
此外,還通過染色實驗檢測了各組小鼠腫瘤細胞的增殖,凋亡,細胞總ROS水平,使用WB檢測了增殖,凋亡和鐵死亡相關蛋白的表達。如圖7D-7F所示,這些結果和體外實驗結果一致,miR-101-3p mimic的納米載體會抑制腫瘤生長指標,促進鐵死亡指標。

圖7 miR-101-3p的有效基因傳遞通過促進鐵死亡在體內對腫瘤產生治療作用
總之,miR-101-3p通過促進腫瘤細胞鐵死亡抑制腫瘤生長,本研究設計的納米基因載體策略可以恢復腫瘤中miR-101-3p的表達,這可能是一種潛在的治療多種腫瘤的有效技術。
參考文獻:
Luo Yifeng., Niu Gang., Yi Hui., Li Qingling., Wu Zhiqiang., Wang Jing., Yang Juan., Li Bo., Peng Yuan., Liang Ying., Wang Weiwei., Peng Zhenwei., Shuai Xintao., Guo Yu.(2021). Nanomedicine promotes ferroptosis to inhibit tumour proliferation in vivo. Redox Biol, 42(undefined), 101908. doi:10.1016/j.redox.2021.101908






