外泌體linc-ROR介導癌細胞和脂肪細胞之間的串擾,促進胰腺癌腫瘤的生長

胰腺癌(PC)是最棘手的癌癥之一,被認為是預后最差的消化系統腫瘤。外泌體是微環境中腫瘤細胞和基質細胞之間相互交流的重要介質。腫瘤的發展不僅由癌細胞決定,還受腫瘤微環境(Tumor microenvironment, TME)中缺氧、脂質和間質細胞這三個重要因素的調控。肥胖與包括PC在內的幾種癌癥的風險增加有關,并增加PC的發病率和死亡率。然而,PC衍生的外泌體在TME的進展和與脂肪細胞的串擾中的潛在分子機制尚未闡明。因此,有作者對此進行了研究,并把研究結果發表在《Molecular Therapy - Nucleic Acids》,IF:8.886。
技術路線:
主要研究結果:
1. PC細胞衍生的linc-ROR相關外泌體的特性和作用
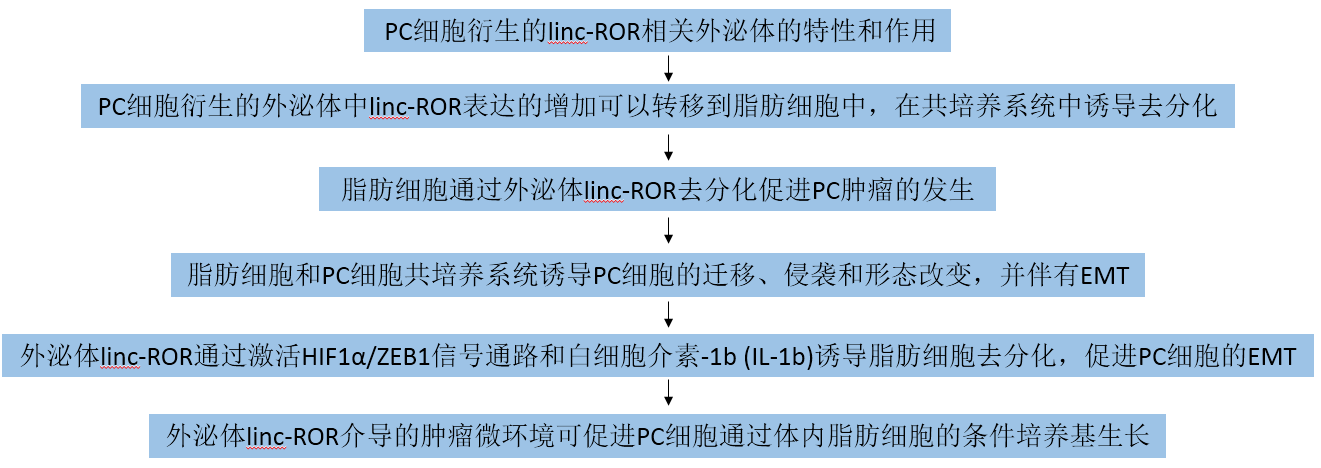
為了研究外泌體對PC細胞釋放的脂肪細胞的影響,從培養基的上清(無外泌體血清)中分離出外泌體,并通過透射電子顯微鏡(TEM)和納米顆粒跟蹤分析(NTA)進行定量。透射電鏡顯示直徑為30 ~ 150 nm的清晰圓形顆粒(圖1A),NTA顯示出類似大小的外泌體分布(圖1B和1C;)來源于PANC-1和BxPC-3細胞。在建立的PC細胞系(PANC-1, AsPC-1, MIA-PACA-2, CFPAC-1和BxPC-3)中觀察到linc-ROR的表達高于永生的正常胰腺細胞系(CCCHPE- 2)(圖1D)。此外,外泌體linc-ROR的差異表達與細胞內linc-ROR一致(圖1E)。Western blot分析從CC-HPE-2、PAN-1和BXPC-3細胞上清分離的外泌體中提取的蛋白,顯示了外泌體蛋白CD9和TSG101的存在(圖1F)。接下來,研究外泌體linc-ROR的穩定性。從PANC-1上清液中分離出的外泌體作為參考,用RNase A (10 mg/mL)培養0、30、60和90 min,在每個時間點測量外泌體linc-ROR表達(圖1G)。此外共聚焦顯微鏡證實了脂肪細胞攝取PC細胞外泌體的能力(圖1H和2C)。脂肪細胞作為受體細胞,對PC細胞的外泌體具有吸收效率,表明外泌體linc-ROR可傳遞給脂肪細胞,在PC細胞和脂肪細胞之間的生物學功能調節中發揮著重要作用。
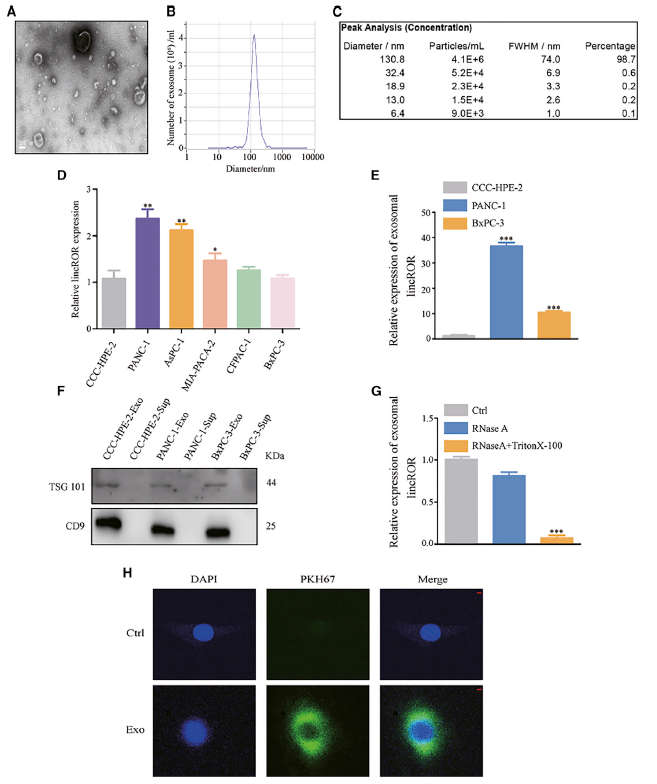
圖1 PC細胞衍生的外泌體的特征和作用
2. PC細胞衍生的外泌體中linc-ROR表達的增加可以轉移到脂肪細胞中,在共培養系統中誘導去分化
作者接下來使用體外間接共培養模型研究了外泌體linc-ROR在誘導脂肪細胞去分化中的作用(圖2A)。為了探究外泌體linc-ROR在脂肪細胞脫分化中的作用機制,作者繼續誘導3T3-L1脂肪細胞5天,使其成為具有獨特脂滴的成熟脂肪細胞(圖2B)。脂滴經紅油染色呈規則的圓形。當從PC細胞中分離出來的外泌體(綠色熒光染料,pkh67標記)與脂肪細胞共培養時,激光掃描共聚焦顯微鏡(LSCM)顯示,受體細胞(藍色熒光染料,DAPI標記)隨著時間的增加表達更高的攝取潛能(圖2C)。這證實了吸收能力是依賴于時間的。
在與轉染sh陰性對照(CoshCtrl)的PANC-1細胞共培養過程中,與轉染shROR (CoshROR)相比,成熟脂肪細胞表現出脂滴明顯減少,細胞外觀呈拉長狀,類似成纖維細胞的形態(圖2D)。為了確定外泌體linc-ROR誘導脂肪細胞脫分化的機制,采用western blot和實時熒光定量PCR分析PID 11不同實驗條件下脂肪細胞的基因表達水平。正如預期的那樣,在一些成熟的脂肪細胞特異性標記物,如葡萄糖轉運體-4 (GLUT4)、增殖激活受體γ (ppar)和激素敏感脂肪酶(HSL)的表達方面,我們觀察到,與CoshROR或單個脂肪細胞(PBS-Adi)組相比,CoshCtrl組明顯降低了它們的表達水平(圖2E)。此外,還檢測了一些成纖維細胞特異性基因的表達水平,如α平滑肌肌動蛋白(α-SMA)、基質金屬蛋白酶11 (MMP11)和膠原蛋白I(圖2E)。共培養6天后其表達水平顯著升高,進一步支持脂肪細胞向成纖維細胞樣細胞的脫分化過程。

圖2 PC細胞衍生的外泌體中linc-ROR表達水平的升高可以通過共培養系統轉移到脂肪細胞并誘導去分化
3. 脂肪細胞通過外泌體linc-ROR去分化促進PC腫瘤的發生
功能上,菌落形成分析的結果顯示,在共培養體系中,敲低/過表達外泌體linc-ROR表達顯著降低/增強了PC細胞的生長活力(圖3A和3B),實時細胞分析(RTCA) xCELLigence實驗產生了類似的結果(圖3C和3D)。如圖所示,共培養/較高linc-ROR組比各自的對照組表現出更好的生長。這些結果也被EdU實驗結果所證實(圖3G和3H)。綜上所述,外泌體linc-ROR表達較高的脂肪細胞脫分化后,PC細胞增殖能力增強。
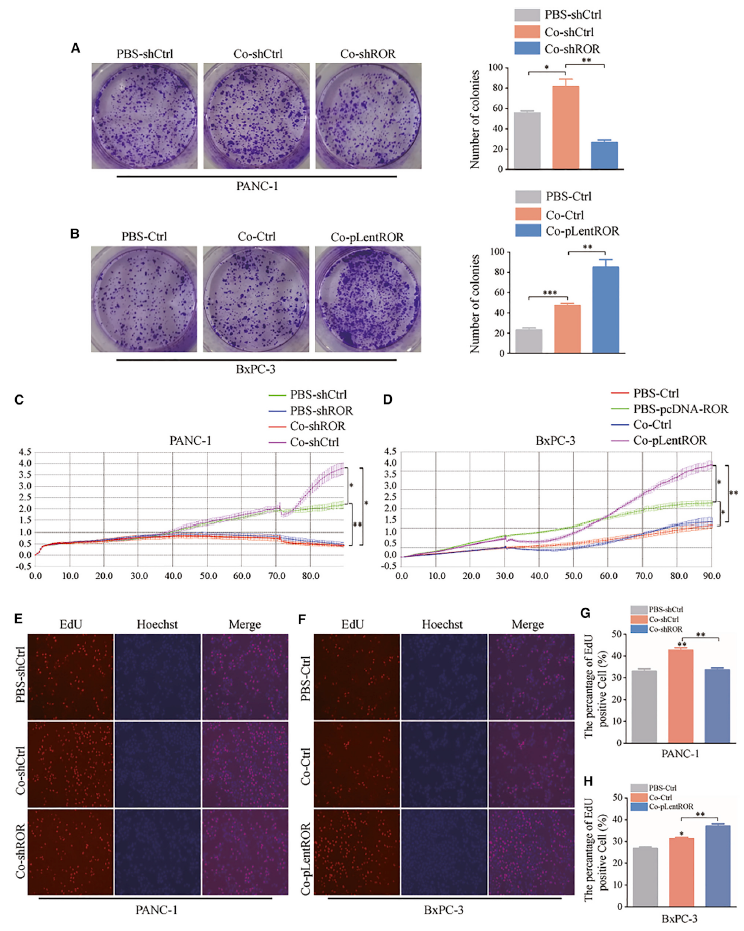
圖3 脂肪細胞通過外泌體linc-ROR去分化促進PC腫瘤的發生
4. 脂肪細胞和PC細胞共培養系統誘導PC細胞的遷移、侵襲和形態改變,并伴有EMT
研究結果還表明,與PBS-shCtrl/PBS-Ctrl相比,脂肪細胞和外泌體linc-ROR共培養體系的條件培養基增強了PC細胞系的運動性(圖4A和4B)。重要的是,作者發現由外泌體linc-ROR表達增加引起的脂肪細胞脫分化使PC細胞更有運動能力,如圖4A和4B所示(圖4A和4B)。此外,經外泌體linc-ROR處理的脂肪細胞產生的條件培養基在很大程度上誘導PC細胞通過Transwell過濾器遷移和侵襲(圖4C和4F)。圖像還顯示,條件培養液改變了PC細胞的形態,從凝聚型轉變為分散型(圖5B),典型表現為細胞間連接丟失和細胞偽足擴展,免疫熒光(IF)實驗顯示,間質標記物波形蛋白表達增加,上皮標記物E-cadherin表達減少(圖5A)。這些數據證實了外泌體linc-ROR的表達增加,通過共培養系統作用于脂肪細胞,促進體外PC轉移。

圖4 脂肪細胞和PC細胞共培養系統誘導細胞遷移和侵襲
圖5 共培養系統改變了PANC-1細胞的形態,誘導了EMT
5. 外泌體linc-ROR通過激活HIF1α/ZEB1信號通路和白細胞介素-1b (IL-1b)誘導脂肪細胞去分化,促進PC細胞的EMT
接下來,作者深入研究了外泌體linc-ROR和脂肪細胞條件培養基在PC微環境中的生物學功能。如圖6A所示,只有外泌體linc-ROR增加的脂肪細胞表現出脫分化,最終隨著共培養時間的延長(0 h、24 h和48 h)促進HIF1α的表達。此外,還測量了與脂肪細胞共培養的PANC-1細胞中ZEB1的表達(圖6B)。結果表明,脂肪細胞在共培養過程中不僅促進了HIF1α的表達,而且隨著時間的推移也促進了ZEB1的表達。在共培養系統中,HIF1α在ZEB1信號通路的有效重組中發揮了核心作用。使用實時定量PCR和western blotting來研究HIF1α是否在共培養條件下與作為對照的PBS激活ZEB1通路(圖6C)。正如預期的那樣,小干擾RNA (siRNA) (si-HIF1α)誘導的HIF1α的減少降低了ZEB1的表達。特別是HIF1α和共培養模型對ZEB1具有協同的正調控作用(圖6I)。
為了增加上述結果的嚴謹性,使用轉染了pLent-ROR的BxPC-3細胞來研究linc-ROR過表達是否會導致下游HIF1α-ZEB1表達的改變。實驗結果揭示了linc- ROR和共培養條件在HIF1α-ZEB1信號通路中的有效性和可行性,并與plt陰性對照或pbs對照處理的BxPC-3細胞進行了比較(圖6D-6F)。IL-1b等細胞因子在PC微環境中通過旁分泌信號在脂肪細胞和腫瘤細胞之間發揮重要的介導作用。因此,通過ELISA檢測了與脂肪細胞共培養微環境中IL-1b的濃度(圖6G和6H)。數據顯示較高的外泌體linc-ROR可刺激脂肪細胞分泌IL-1b。此外,對PC細胞的western blot分析顯示,ZEB1誘導的EMT細胞發生了典型的變化,包括E-cadherin蛋白表達降低,而vimentin蛋白表達顯著升高(圖6C, 6F, 6I)。因此,這些結果表明,外泌體linc-ROR誘導脂肪細胞脫分化,并提高PC細胞中ZEB1的表達,從而誘導EMT。
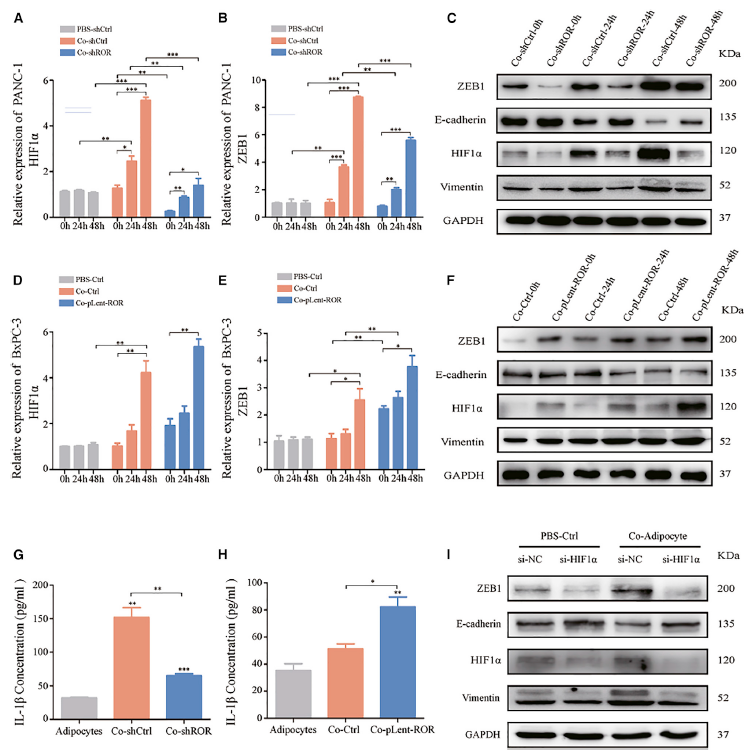
圖6 外泌體linc-ROR通過激活HIF1α-ZEB1信號通路和增加IL-1b,誘導脂肪細胞去分化,促進PC細胞的EMT
6. 外泌體linc-ROR介導的腫瘤微環境可促進PC細胞通過體內脂肪細胞的條件培養基生長
為了進一步評估外泌體linc-ROR在脂肪細胞轉化表型中的作用,從而促進體內PC增殖的進程,將BxPC-3細胞與由BxPC-shCtrl (PBS-Ctrl和Co-Ctrl)衍生的外泌體刺激的脂肪細胞條件培養基混合或轉染pLent-ROR (PBSpLent- ROR和CopLent-ROR)的脂肪細胞皮下接種裸鼠(圖7A)。用過表達的外泌體linc-ROR處理的去分化脂肪細胞在腫瘤內注射條件培養基(每周3次)可在不同時間點產生最大的腫瘤生長體積(圖7B)。5周后,觀察到BxPC-3細胞與CopLent-ROR混合產生的腫瘤結節比BxPC-3細胞單獨(Co-Ctrl)或PBS-Ctrl混合產生的腫瘤結節更大(圖7C)。PBS-Ctrl組和PBS-pLent-ROR組Ki-67蛋白表達顯著低于Co-Ctrl組和CopLent-ROR組(圖7D)。這些結果表明,TME中的外泌體linc-ROR誘導脂肪細胞脫分化,促進體內PC生長。同時,以往的外泌體表征研究表明,外泌體包裹的linc-ROR在膜的保護下具有更好的穩定性(圖1G和1H),這是良好的生物標志物的必要前提。為了驗證血清中外泌體linc-ROR的診斷性能,在同一驗證隊列中測量了它的表達(圖7E)。此外,根據48例PC患者和48例健康個體的外泌體linc-ROR表達情況進行受試者-操作特征(ROC)曲線分析(圖7F)。如預期,外泌體linc-ROR檢測PC的ROC曲線下面積(AUC)為0.854。血清外泌體linc-ROR預測PC的最佳臨界值為1.21086 (CRC與健康人相比的fold change),敏感性為72.92%,特異性為95.83%,提示外泌體linc-ROR是一種有前景的診斷PC的血清生物標志物。

圖7 外泌體linc-ROR介導的腫瘤微環境可促進PC細胞通過體內脂肪細胞的條件培養基生長
主要結論:
該研究結果表明,外泌體linc-ROR不僅作為PC的臨床生物標志物,還介導了TME中PC細胞和脂肪細胞之間的串話。暴露于外泌體后,活化的脂肪細胞可能通過釋放細胞因子IL-1b去分化為前脂肪細胞/成纖維細胞樣細胞,IL-1b反過來通過HIF1α-ZEB1軸維持PC細胞的生長和轉移(圖8)。
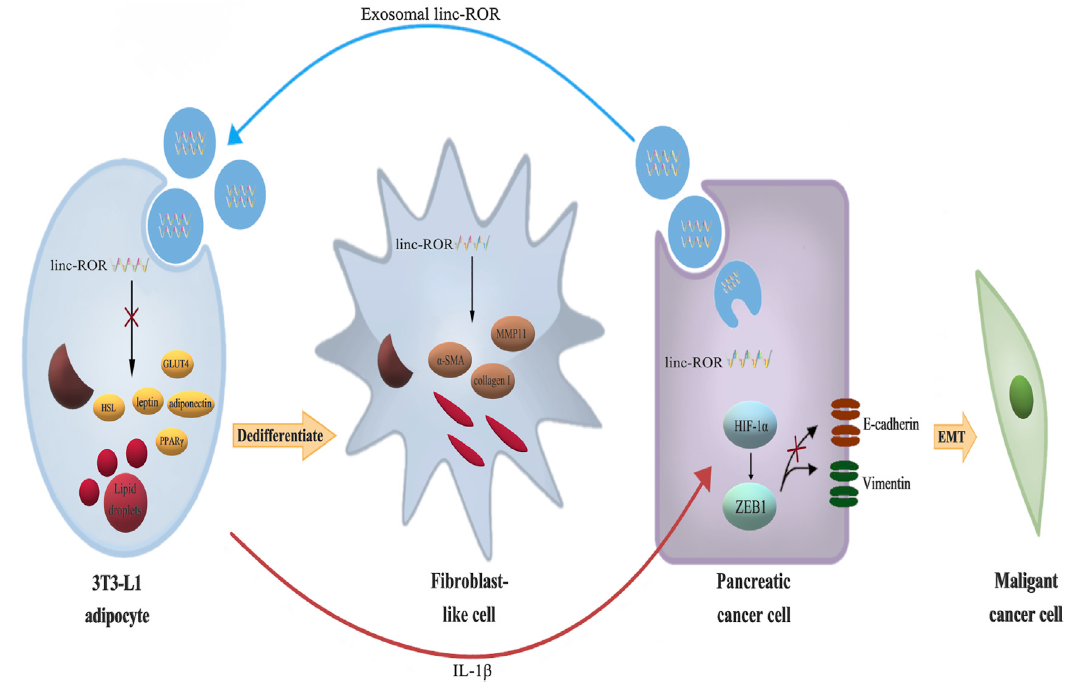
圖8 PC細胞來源的外泌體linc-ROR誘導脂肪細胞去分化為前脂肪細胞/成纖維細胞樣細胞,進而通過細胞因子IL-1b激活HIF1α-ZEB1信號通路維持PC細胞的生長和侵襲






