CircRNA在腫瘤研究中的經典實驗設計思路 EWSR1誘導的circNEIL3通過穩定IGF2BP3促進膠質瘤進展和外泌體介導的巨噬細胞免疫抑制極化
作者通過分析環狀RNA在膠質瘤組織中的表達譜,鑒定了一個來自NEIL3的環狀RNA, hsa_circ_0001460,命名為circNEIL3,在體外和體內促進了膠質瘤的發生和進展。隨后通過不同的通路,闡明circNEIL3促進膠質瘤進展的分子機制。該文章發表在《Molecular Cancer》,IF: 41.44。
技術路線:
主要研究結果:
1. CircNEIL3在膠質瘤組織中表達顯著上調
作者首先分析了39個膠質瘤組織(11個GBM和28個低級別膠質瘤(LGG))和8個正常腦組織(NBTs)中環狀RNA的表達譜。火山圖顯示,在GBM和LGG之間,以及LGG和NBTs之間,circRNA表達有系統性差異(圖1A, B),在膠質瘤組織中差異上調的環狀RNA (Log2FC≥4, P adj≤0.05),并鑒定出hsa_circ_0001460 (圖1C)。與NBTs相比,CircNEIL3在膠質瘤組織中顯著上調,且隨著膠質瘤分級的增加其表達增加(圖1D)。ROC曲線表示circNEIL3可預測膠質瘤患者不良預后(圖1E)。通過UCSC基因組學研究所生物信息學網站,發現circNEIL3在NEIL3基因的第8外顯子和第9外顯子之間反接,長度為596 nt(圖1)。使用發散引物擴增circNEIL3的后剪接位點,并通過Sanger測序確認(圖1F)。凝膠電泳分析結果顯示,circNEIL3只能從cDNA中擴增出來,而從cDNA和gDNA中可以擴增出線性形態(圖1G)。此外, RNase R和放線菌素D的處理證實了circNEIL3比NEIL3更穩定(圖1H, I)。核質分離實驗和FISH分析顯示,circNEIL3主要定位于細胞質(圖1J, K)。綜上所述,circNEIL3在膠質瘤組織中表達顯著上調,且在GBM中表達最高,提示其參與了膠質瘤的發生和惡性進展。
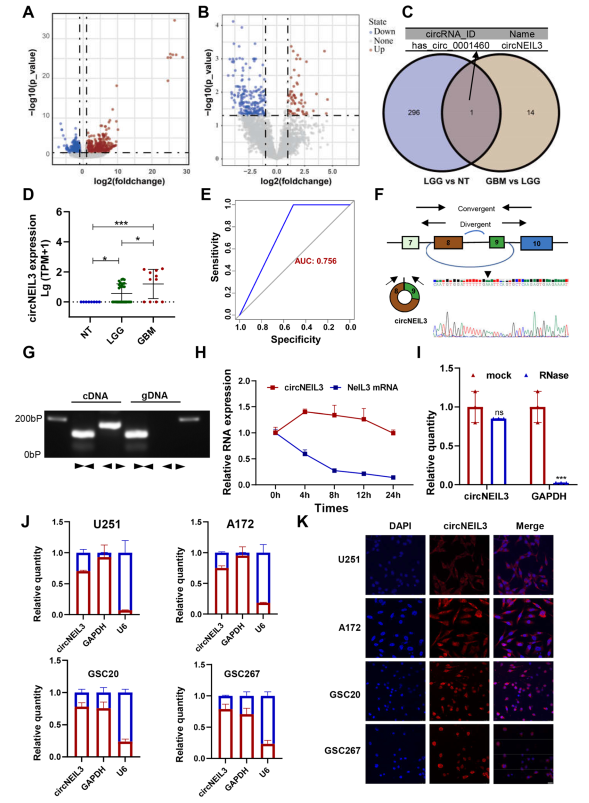
圖1 CircRNA在膠質瘤中的表達譜和circNEIL3的特征
2. CircNEIL3在體外和體內均可促進膠質瘤的發生
功能實驗表明:下調circNEIL3顯著抑制細胞增殖、遷移和侵襲,過表達circNEIL3顯著促進這些細胞行為(圖2A-D)。體內實驗顯示,circNEIL3下調可顯著抑制腫瘤生長和侵襲,延長荷瘤小鼠的生存時間,而circNEIL3過表達則會產生相反的效果(圖2E、F)。此外,切除的腫瘤切片免疫組化顯示,circNEIL3敲低的腫瘤組織中Ki67和CD44的表達低于載體組,而circNEIL3過表達則相反(圖2G)。綜上所述,circNEIL3在調節腫瘤發生和膠質瘤進展方面具有重要的功能。
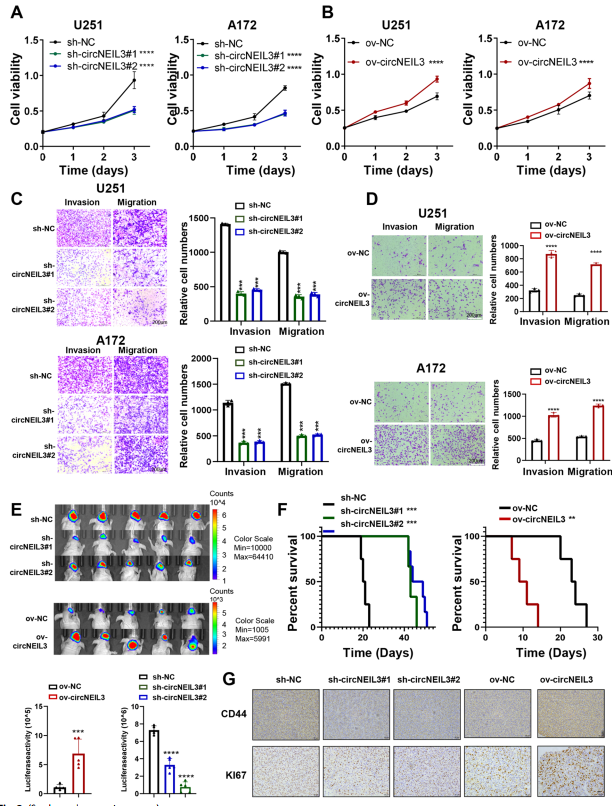
圖2 CircNEIL3在體外和體內促進GBM細胞增殖和轉移
3. EWSR1促進了circNEIL3在膠質瘤中的生物發生
利用CircInteractome數據庫和starBase 3.0數據庫在circNEIL3的上下行區域預測了EWSR1的三個結合位點,分別稱為序列1、序列2和序列3(圖3A)。隨著膠質瘤級別的升高,EWSR1表達水平升高,高表達的患者預后較差(圖3B)。此外,敲低EWSR1可以抑制GBM細胞的增殖、侵襲和遷移(圖3C、D)。在circRNA轉錄組中,發現circNEIL3與EWSR1呈正相關(圖3E),而在EWSR敲低的U251和A172細胞中,circNEIL3的表達明顯下降(圖3F)。將U251和A172細胞置于缺氧條件下0 h、6 h、12 h和24 h,隨著暴露時間的增加,EWSR1和circNEIL3的表達上調(圖3G,h)。通過RIP-qPCR檢測證實,EWSR1能與NEIL3 pre-mRNA序列1和序列3結合,且在缺氧條件下結合能力顯著上調(圖3I)。最后設計拯救實驗, EWSR1過表達誘導U251和A172細胞增殖、遷移和侵襲增加,可通過下調circNEIL3來逆轉(圖3J-L)。
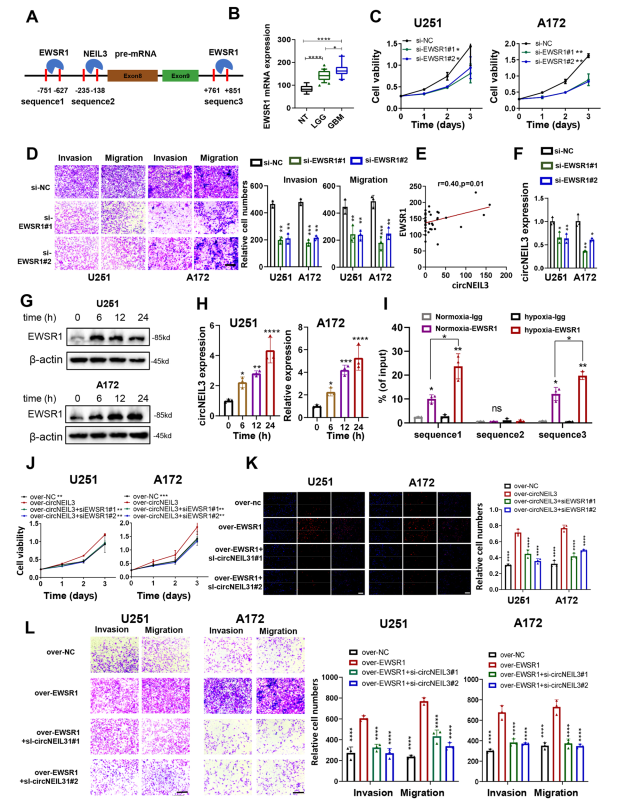
圖3 EWSR1促進circNEIL3的生物發生
4. CircNEIL3在物理上與IGF2BP3相互作用,并抑制泛素/蛋白酶體介導的IGF2BP3降解
為了探索circNEIL3誘導GBM細胞進展的分子機制,首先進行了RNA下拉分析和質譜分析,以探索與circNEIL3結合的潛在蛋白。共鑒定出50個與circNEIL3相互作用的蛋白,其中不包括AGO2,排除了circNEIL3作為ceRNA的可能性。將質譜數據與CircInteractome數據庫中預測的RBP進行交叉。發現circNEIL3與IGF2BP3蛋白結合(圖4A)。RNA pull-down和RIP-qPCR進一步證實了circNEIL3與IGF2BP3的相互作用(圖4B, C)。RNA fish -免疫熒光分析,發現circNEIL3與IGF2BP3在細胞質中共定位(圖4D)。IGF2BP3由2個RNA識別基序(RMS)和4個KH結構域組成。因此,建立了6個flag標記的載體,并通過Western blot進行了確認,以測試哪個區域與circNEIL3相互作用(圖4E, F)。RIP-qPCR檢測顯示,circNEIL3主要結合在KH3-4區域,表明這個結構域負責招募circNEIL3(圖4G)。然后為了識別IGF2BP3結合的circNEIL3序列,設計了三個突變位點,最終觀察到IGF2BP3與circNEIL3的第三個位點結合(圖4H)。這些結果表明circNEIL3在細胞質中與IGF2BP3發生相互作用。
然而,circNEIL3并沒有顯著改變IGF2BP3的mRNA水平(圖4I),但顯著促進IGF2BP3及其下游靶點CDK4/6、CD44和c-MYC的蛋白表達(圖4J),表明circNEIL3可能通過破壞IGF2BP3蛋白的穩定來調控膠質瘤的惡性進展。由于過表達circNEIL3可以提高IGF2BP3的蛋白表達水平,延長IGF2BP3的半衰期(圖4K),表明circNEIL3通過蛋白酶體活性調控IGF2BP3蛋白的穩定性。circNEIL3過表達降低了IGF2BP3的泛素化(圖4L)。然后,通過Ubibrowser數據庫鑒定出一個泛素化賴氨酸(K)殘基(K450),位于IGF2BP3的KH3結構域(圖4N)。利用Uniport數據庫預測了IGF2BP3的K450位點在6個物種中高度保守(圖4N),并將K450泛素化位點可視化(圖4O)。然后,作者將預測位點從賴氨酸(K)突變為精氨酸(R),以確認其作為泛素化靶點的作用。免疫沉淀(IP)結果顯示,與野生型IGF2BP3相比,K450突變顯著降低了IGF2BP3的泛素化水平,且在表達突變體的細胞中,cirNEIL3過表達導致的泛素化增強也被抑制(圖4M),突顯出K450是IGF2BP3的主要泛素化位點。這些結果表明,circNEIL3通過抑制泛素/蛋白酶體依賴的降解,增強IGF2BP3蛋白的穩定性,從而促進膠質瘤的惡性進展。
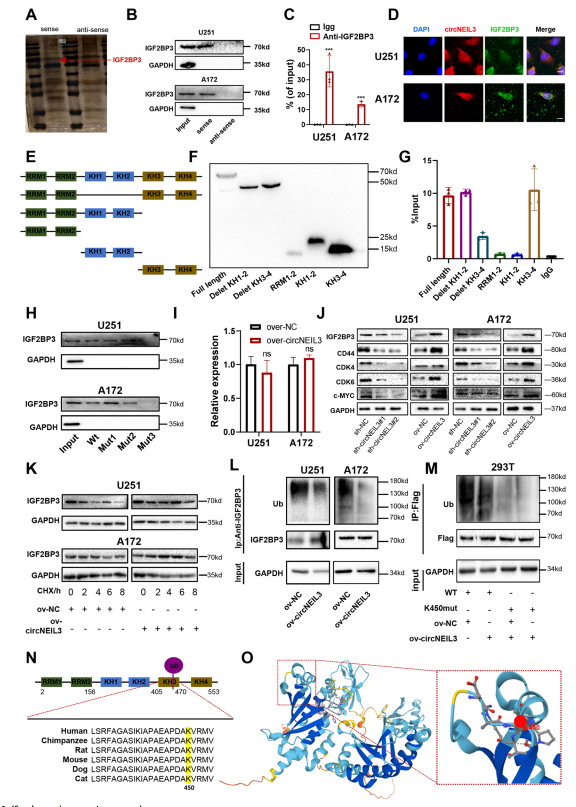
圖4 CircNEIL3與IGF2BP3相互作用并抑制其泛素化
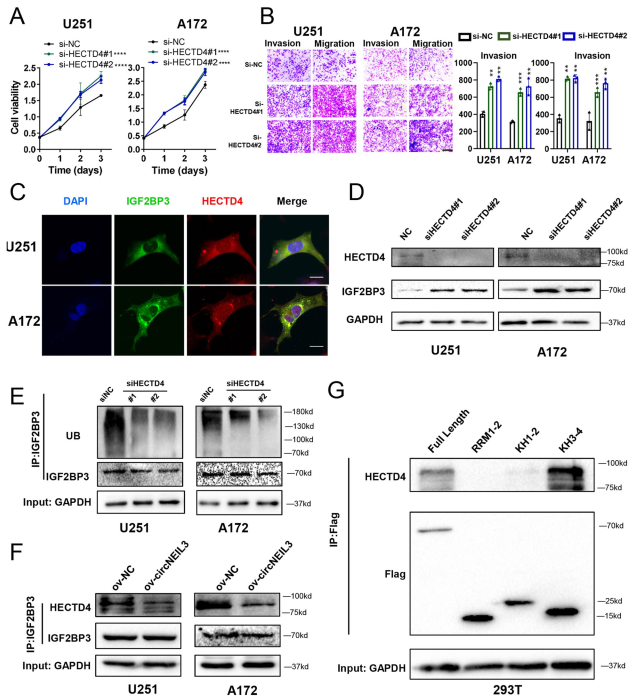
5. CircNEIL3通過抑制IGF2BP3蛋白HECTD4 -介導的泛素化
co-IP和質譜分析,發現屬于E3泛素連接酶的HECD家族的蛋白HECTD4可以與IGF2BP3結合。細胞實驗證明HECTD4可以抑制GBM細胞的增殖、侵襲和遷移(圖5A, B)。免疫熒光實驗,證實IGF2BP3與細胞質中的HECTD4共定位(圖5C)。此外,在HECTD4敲除GBM細胞中,IGF2BP3蛋白水平顯著升高(圖5D),而其泛素化水平明顯降低(圖5E),這表明在膠質瘤中,HECTD4作為E3泛素連接酶通過泛素-蛋白酶體途徑降解IGF2BP3。
過表達circNEIL3可以阻斷IGF2BP3與HECTD4的結合(圖5F),這解釋了circNEIL3是如何穩定IGF2BP3的。Co-IP實驗觀察到HECTD4結合在IGF2BP3的KH3-4結構域,這是circNEIL3與IGF2BP3相互作用的同一位點(圖5G和圖4G)。這些數據表明circNEIL3通過阻止HECTD4介導的泛素化而穩定IGF2BP3蛋白。
圖5 CircNEIL3阻斷IGF2BP3與HECTD4的結合
6. CircNEIL3促進膠質瘤中巨噬細胞的浸潤
如圖6A所示,與circNEIL3低表達組相比,circNEIL3高表達組TME細胞浸潤更多,免疫評分和基質評分更高,腫瘤純度更低。與circNEIL3低表達的膠質瘤相比,circNEIL3高表達的膠質瘤中巨噬細胞浸潤明顯增加。使用Transwell實驗發現,與NC組相比,過表達circNEIL3的GBM細胞的條件培養基(CM)顯著促進THP1分化的巨噬細胞遷移(圖6B),而來自circNEIL3敲低的GBM細胞的CM則顯示相反的結果(圖6C)。總之,circNEIL3過表達的腫瘤細胞可以驅使巨噬細胞浸潤到膠質瘤微環境。
GSEA結果表明,與circNEIL3低樣本相比,circNEIL3高樣本中YAP1信號基因標記高度富集(圖6D)。對TCGA膠質瘤標本進行IGF2BP3的檢測也得到了同樣的結果(圖6E)。qRT-PCR實驗驗證了circNEIL3促進CCL2和LOX表達的結果(圖6F),而這種由circNEIL3過表達誘導的表達增強可以通過IGF2BP3敲低來拯救(圖6G)。最后,circNEIL3可以增加GBM細胞中YAP1和LOX的蛋白表達(圖6H)。過表達circNEIL3引起的表達增加也可以通過敲低IGF2BP3來消除(圖6I)。總之,這些結果表明circneil3過表達的GBM細胞可能通過激活YAP1信號驅動巨噬細胞浸潤到腫瘤相關的微環境。
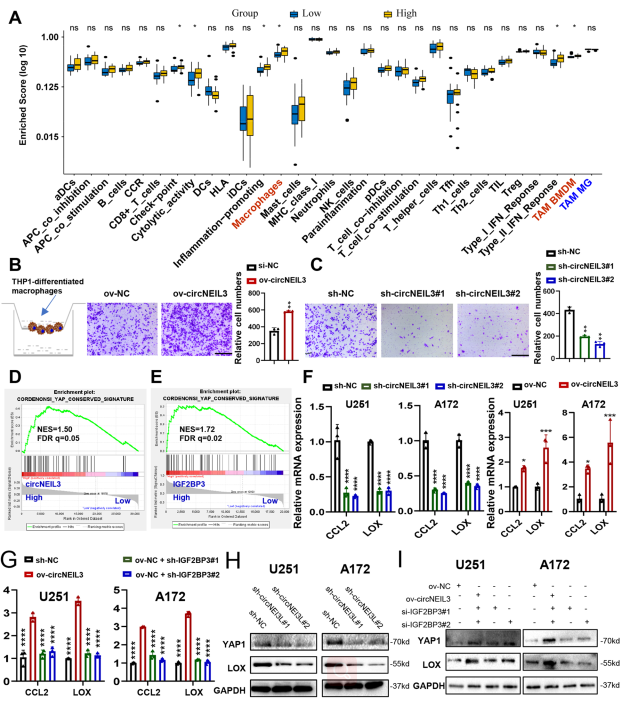
圖6 CircNEIL3促進膠質瘤內巨噬細胞浸潤
7. CircNEIL3可通過hnRNPA2B1被包裝成外泌體
circNEIL3下拉實驗的質譜數據,發現circNEIL3可以與hnRNPA2B1結合,hnRNPA2B1被報道可以運輸各種RNA進入外泌體。并且在GBM細胞中通過RIP和RNA下拉實驗證實了circNEIL3和hnRNPA2B1之間的相互作用(圖7A, B)。在hnRNPA2B1敲低的GBM細胞中,circNEIL3在細胞中表達上調,在外泌體中表達下調(圖7C)。綜上所述,這些結果表明,circNEIL3可以被hnRNPA2B1包裝成外泌體。
8. 外泌體向TAMs傳遞circNEIL3,從而使TAMs通過穩定IGF2BP3獲得免疫抑制特性
流式細胞術結果表明,circNEIL3過表達顯著上調巨噬細胞激活標志物CD163(圖7D)。隨著circNEIL3在外泌體中的表達增加,巨噬細胞激活標志物、免疫抑制分子和SPP1(維持膠質瘤細胞存活并刺激血管生成)顯著上調(圖7E, F,圖S11J)。總之,這些結果表明,外泌體可以將circNEIL3傳遞給TAMs,從而使它們獲得血管生成和免疫抑制特性。為了闡明circNEIL3介導巨噬細胞免疫抑制特性的機制,通過RNA下拉和RIP實驗發現,在THP1分化的巨噬細胞中,circNEIL3與IGF2BP3結合的位點與腫瘤細胞相同(圖7G, H)。此外,在腫瘤細胞中觀察到,在THP1分化的巨噬細胞中,circNEIL3增加了IGF2BP3蛋白的表達,抑制了IGF2BP3的泛素化(圖7I, J)。因此,與GBM細胞一樣,IGF2BP3可以作為circNEIL3在巨噬細胞中的下游效應因子,介導巨噬細胞向免疫抑制表型極化。western blot檢測結果證實,在THP1分化的巨噬細胞中,過表達circNEIL3和IGF2BP3均能提高YAP1蛋白的表達,而敲除它們的結果則相反(圖7K, L)。此外,敲除IGFB2P3可消除過表達circNEIL3對YAP1蛋白表達的增強(圖7M),表明circNEIL3通過穩定IGF2BP3蛋白來增強YAP1的表達,從而促進巨噬細胞的免疫抑制表型極化。為了進一步驗證circNEIL3在體內對巨噬細胞免疫抑制極化的影響,將過表達cicrNEIL3的巨噬細胞或陰性對照載體與膠質瘤細胞共原位植入裸鼠大腦。與NC組相比,circNEIL3過表達組腫瘤生長加快,荷瘤小鼠的生存時間延長(圖7N-P)。為了進一步證明circNEIL3通過IGF2BP3-YAP1軸發揮作用,在臨床膠質瘤患者局部組織中進行了免疫熒光染色實驗。這些結果表明,IGF2BP3可以作為circNEIL3在巨噬細胞中的下游效應因子,使巨噬細胞獲得免疫抑制特性,從而促進膠質瘤的進展。
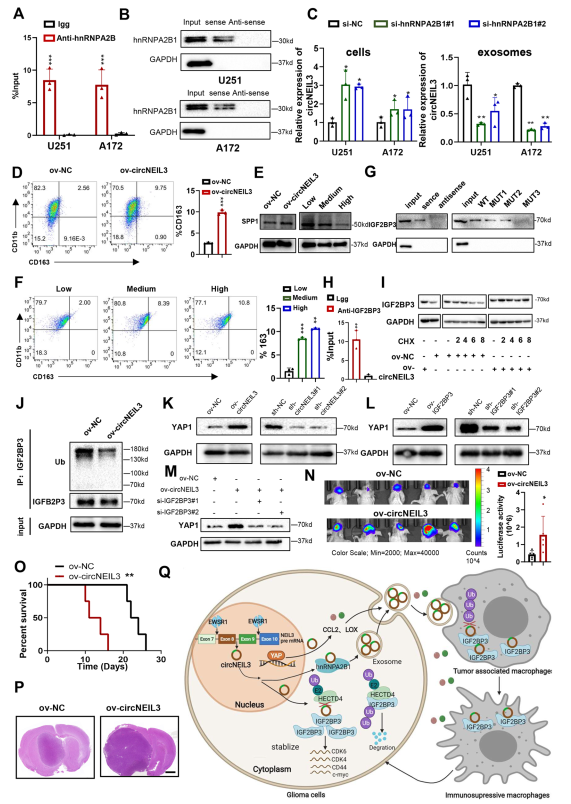
圖7外泌體可將circNEIL3傳遞給TAMs,從而使其獲得血管生成和免疫抑制特性
結論:
作者發現了一種在人腦膠質瘤組織中上調的新型環狀RNA circNEIL3。隨著膠質瘤分級的增加,受EWSR1調控的circNEIL3表達增加。在功能上, circNEIL3在體外和體內促進了膠質瘤的發生和進展。從機制上講,circNEIL3通過阻止HECTD4介導的泛素化來穩定IGF2BP3,這是一種已知的致癌蛋白。此外,circNEIL3過表達的膠質瘤細胞可驅動巨噬細胞浸潤至TME。最后,circNEIL3可通過hnRNPA2B1打包成外泌體,傳遞給浸潤的TAMs,從而使其通過穩定IGF2BP3獲得免疫抑制特性,進而促進膠質瘤的發生和惡性進展(圖7Q)。這些研究結果表明,circNEIL3可能是一種新的預后生物標志物和有希望的膠質瘤治療靶點。