線粒體代謝酶輸入缺陷引起異位代謝應激
實驗方法:蛋白表達與純化,質粒構建,免疫印跡,熒光顯微法,亞細胞分離實驗,體內泛素化實驗,Pull-down分析,斑點試驗,RNA sequencing,嘌呤霉素摻入試驗,陽離子代謝產物的LC-MS/MS分析,多核糖體分析
線粒體蛋白輸入缺陷與多種疾病相關。盡管非輸入的線粒體蛋白具有很大的聚集風險,但它們的積聚如何導致細胞功能障礙仍不清楚。在這里,作者證明了非進口的檸檬酸合成酶被泛素連接酶SCFUcc1靶向蛋白酶體降解。出乎意料的是,作者的結構和遺傳分析表明,非輸入的檸檬酸合酶似乎在細胞質中形成了酶活性構象。它的過量積累引起檸檬酸鹽的異位合成,進而導致糖的碳通量失衡,氨基酸和核苷酸庫減少,以及生長缺陷。在這些條件下,翻譯抑制被誘導,并作為一種保護機制緩解了生長缺陷。作者認為,線粒體輸入失敗的后果并不局限于蛋白毒性損傷,而是非輸入性代謝酶的積累引發了異位代謝應激。本研究于2023年4月發表在期刊《Science Advances》(IF:14.957)上。
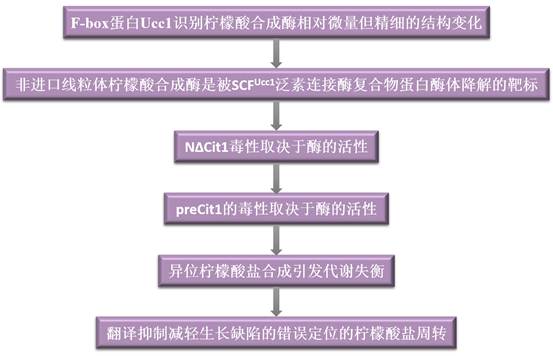
技術路線:
主要研究結果:
1、F-box蛋白Ucc1識別檸檬酸合成酶相對微量但精細的結構變化
為研究底物識別亞基Ucc1識別檸檬酸合成酶的機制,作者進行了X射線晶體結構分析。與常用的模擬底物蛋白的肽段不同,作者在2.30-?分辨率下成功確定了Ucc1-Skp1與全長Cit2復合物的結構(圖1A)。Skp1(殘基1 ~ 84和97 ~ 112)的N端區域的電子密度在該復合物中不可見(圖1A)。Cit2-Ucc1-Skp1復合物結構包含1個Ucc1-Skp1復合物和1個Cit2二聚體(圖1A)。該四元復合物具有彎曲的結構,其中Skp1和Cit2位于Ucc1的兩端。此外,Ucc1持有兩個Cit2分子中的一個(圖1A)。
在相互作用面上,Cit2中的H14和H20螺旋分別與Ucc1中的H9和H10螺旋相關聯,Cit2中的H6-H7 loop與Ucc1中的S10鏈相關聯(圖1B)。位于這些表面的殘基中,Cit2中的D154和E309分別與Ucc1中的K345和R184形成鹽橋,而Cit2中的E309和S409/S410分別與Ucc1中的Y185和E212形成氫鍵(圖1B)。含有D154A、E309A或S409A/S410A突變的Cit2突變體與Ucc1的結合減少(圖1C)。類似地,含有R184A/Y185A、E212A或K345A突變的Ucc1突變體與Cit2的結合減少(圖1D)。
Ucc1-Skp1-Cit2四元復合物中Cit2的結構與圖1E中Cit2的開放形式[Apo-Cit2(A)]幾乎完全一致。該形式不含其底物草酰乙酸(OAA)和乙酰輔酶A。作者還測定了Cit2與OAA和CoA形成復合物的閉合形式的晶體結構。這里用CoA代替乙酰CoA,以防止結晶過程中的反應。作者發現,在OAA和CoA存在下,Cit2發生了配體誘導的構象變化,包括E309的移動,導致Cit2中的E309與Ucc1中的Y185之間的氫鍵以及Cit2中的E309與Ucc1中的R184之間的鹽橋被破壞(圖S2A)。也許更關鍵的是,這種構象變化還涉及Cit2中螺旋14的大量移動,導致空間位阻,很可能阻止了Ucc1(圖S2 , A ~ C)的識別。Ucc1優先識別開放(無配體)形式的酶,而不識別閉合(有配體結合)形式的酶(圖S2D)。這些結果表明,與其他研究較多的F-box蛋白,如Fbw7、Cdc4、β-TrCP1和Skp2,發生的典型的degron介導的底物識別不同,Ucc1識別催化過程中底物結合引起的相對細微但精細的結構變化。這是由于極性界面通過氫鍵和鹽橋相互補充的結果。此外,這些結果為之前提出的較高量的糖異生代謝物(如乙酰輔酶A和齊墩果酸)穩定Cit2進一步激活乙醛酸循環的正反饋環路提供了結構基礎。
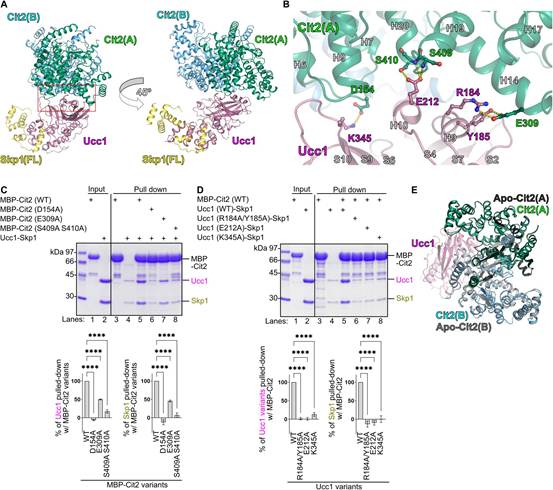
圖1 Ucc1-Skp1復合物識別檸檬酸合酶的結構基礎
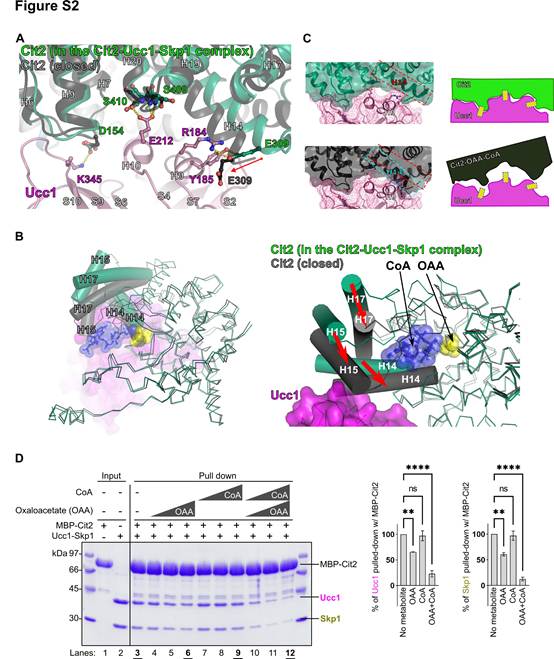
圖S2 配體誘導的Cit2構象變化阻止了它識別Ucc1
2、非進口線粒體檸檬酸合成酶是被SCFUcc1泛素連接酶復合物蛋白酶體降解的靶標
作者解析Apo-Cit1的晶體結構,與Apo-Cit2的晶體結構基本一致(圖2A)。因此,作者推斷胞質中未導入的Cit1也可以通過SCFUcc1靶向蛋白酶體降解。為驗證假設,作者首先構建一個缺少第2至第42位氨基酸的Cit1突變體,該區域含有N端線粒體靶向序列(以下作者稱該突變體為NDCit1)(圖2B-C)。綠色熒光蛋白(GFP)標記的NDCit1定位在細胞質中(圖2D)。亞細胞定位分析進一步證實了NDCit1的細胞質定位(圖2D)。為評估NDCit1的穩定性,作者進行放線菌酮追逐實驗,發現NDCit1被降解,半衰期約為45 min,但加入蛋白酶體抑制劑MG132后,NDCit1被穩定(圖2E)。作者還發現,在溫度敏感的cdc34-2、cdc53-1和skp1-11突變細胞以及Ucc1缺失的細胞中,NDCit1降解減弱(圖2F-G)。此外,NDCit1在體內以Ucc1依賴的方式被泛素化,而不是線粒體形式的成熟Cit1(mtCit1)(圖2H)。這些結果表明NDCit1被SCFUcc1泛素化降解。
接下來,作者利用pull-down實驗分析Ucc1與NDCit1之間的物理相互作用。將裝載有重組3x FLAG-Ucc1-Skp1復合物的抗FLAG親和凝膠與表達血凝素(HA)標記的Cit1或NDCit1細胞制備的酵母裂解液中孵育。如圖2I所示,NDCit1與3xFLAG-Ucc1-Skp1復合物結合(泳道3)。用純化的重組麥芽糖結合蛋白(MBP)標記的Cit1和Ucc1-Skp1復合物的pull-down實驗證實了直接結合(圖2J ,泳道9)。此外,純化的MBP-Cit2與Ucc1-Skp1復合物的直接結合在同一實驗中得到證實(泳道10)。作者注意到,當使用含有Cit1的全細胞裂解液進行基于裂解液的pull-down實驗時,Cit1的成熟線粒體形式(mtCit1)被3xFLAG-Ucc1-Skp1復合物拉下(圖2I ,泳道1 ,中間面板較快遷移帶)。這一發現很可能是由于去垢劑誘導mtCit1從線粒體基質中溶解到裂解液中,并隨后與Ucc1結合。值得注意的是,盡管它在全細胞裂解液中幾乎檢測不到,但與含有導肽的Cit1前體形式(preCit1)相對應的較慢遷移帶也被3xFLAGUcc1-Skp1復合物拉下富集。這一結果提出preCit1也可以被SCFUcc1復合體識別降解的有趣可能性。
盡管Skp1-Ucc1-Cit1復合物的晶體結構目前尚不清楚,但作者發現Cit2中預測對Ucc1結合至關重要的氨基酸殘基在Cit1中是保守的(圖3A)。當NDCit1的D173和S429分別與Cit2的D154和S410同時突變為丙氨酸時,突變體(以下簡稱NDCit1-DS/AA)不再被Ucc1識別并泛素化。與這些結果一致,放線菌酮追趕實驗證明NDCit1-DS/AA在野生型(WT)細胞中的穩定性與NDCit1在ucc1D細胞(5 ~ 8車道)中的穩定性相同(圖3D , 17 ~ 20車道)。這些結果表明,前序列缺失的非輸入型Cit1(NDCit1)被SCFUcc1復合體識別并泛素化降解。此外,作者的研究結果還表明Ucc1似乎可以識別折疊的檸檬酸合酶,因為對Ucc1結合至關重要的氨基酸殘基在三維結構中組裝在同一表面上,盡管它們位于初級序列的較遠位置(圖2)。
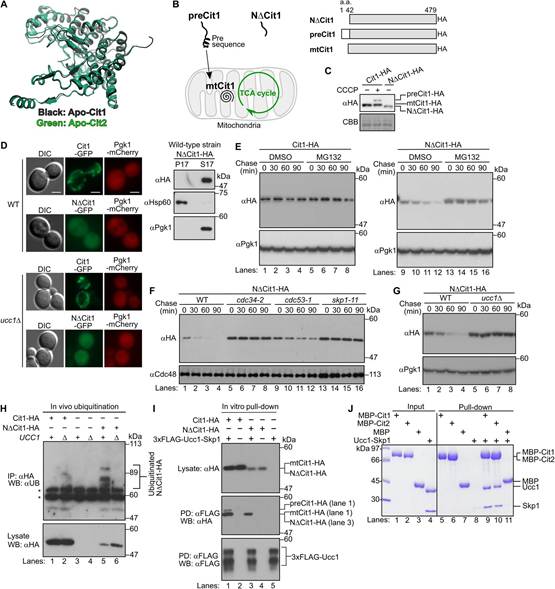
圖2 NDCit1被蛋白酶體以依賴于SCFUcc1泛素連接酶的方式降解
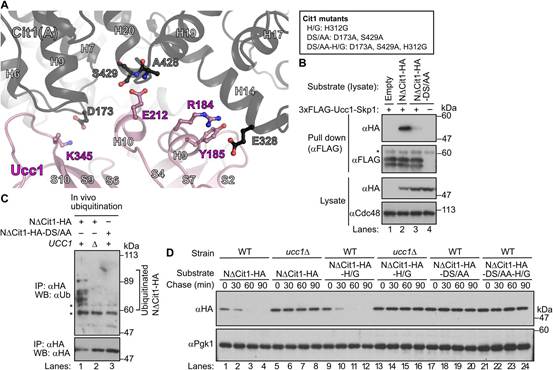
圖3 Ucc1通過其保守的氨基酸識別折疊的檸檬酸合酶
3、NΔCit1毒性取決于酶的活性
為檢驗SCFUcc1介導的非輸入性Cit1降解的生理意義,作者分析NDCit1在細胞質中積累的細胞的生長情況。細胞過表達NDCit1在GAL1啟動子控制下的生長速度略慢于攜帶空質粒的對照細胞(圖4A)。當UCC1被刪除時,NDCit1的表達加劇或DS/AA突變引入NDCit1(圖4A-B),表明毒性是劑量依賴性的。相比之下,過表達WT Cit1的細胞無論是否存在Ucc1或DS/AA突變(圖4A),其生長速度均與對照細胞相當,表明NDCit1和Cit2作為胞質中的酶沒有實質性差異。
由于作者的結構分析表明Ucc1只識別折疊的檸檬酸合成酶,作者假設NDCit1在細胞質中形成酶活性構象。作者通過直接測量細胞的檸檬酸證實NDCit1的檸檬酸合成酶活性(圖4C, line3)。此外,表達NDCit1的ucc1D細胞或表達NDCit1-DS/AA的WT細胞比WT細胞或表達NDCit1的細胞積累了更多的檸檬酸(圖4C)。相比之下,當對檸檬酸合成酶活性至關重要的組氨酸312突變為甘氨酸時,NDCit1和NDCit1-DS/AA的檸檬酸合成酶活性幾乎被消除(圖4C)。此外,H/G突變消除了NDCit1或NDCit1-DS/AA積累導致的生長缺陷表型(圖4B),表明NDCit1毒性來源于酶活性。值得注意的是,H/G突變并不影響NDCit1和NDCit1-DS/AA變體的半衰期(圖3D),表明較低的檸檬酸水平和生長缺陷表型的消除并不是由于蛋白水平的降低。作者還注意到NDCit1及其變體在細胞內是可溶性的,沒有形成不溶性的聚集體(圖4D)。總之,這些結果表明異位積累的檸檬酸合成酶的細胞毒性取決于其酶活性(圖4E)。
有趣的是,與表達NDCit1的細胞相比,表達Cit1的細胞表現出更低的檸檬酸水平,其中大部分Cit1被導入到線粒體中成為成熟形式(mtCit1)(圖4C,比較品系2 ~ 3和品系6 ~ 7)。這很可能是因為mtCit1在線粒體中產生的檸檬酸可能被TCA循環中的酶迅速消耗,而NDCit1產生的檸檬酸可能被消耗的程度較小。作者注意到,在釀酒酵母中沒有發現三磷酸腺苷檸檬酸裂解酶,它將檸檬酸裂解為乙酰輔酶A和齊墩果酸。也有可能調節mtCit1活性的線粒體組分的可用性可能被限制在胞質中。
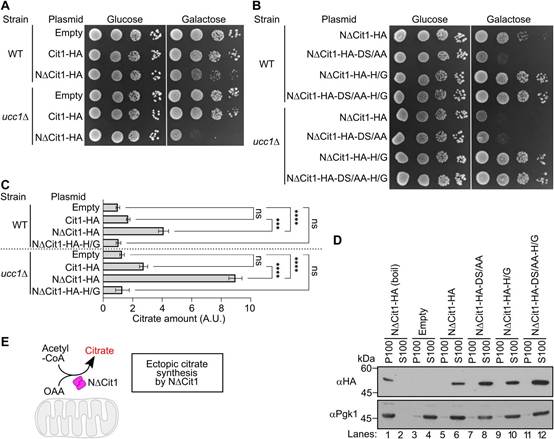
圖4 積聚在細胞質中NDCit1以酶活性依賴的方式對細胞有毒
4、preCit1的毒性取決于酶的活性
到目前為止,作者的研究是基于一個缺乏線粒體靶向序列的突變體(圖5A,左),這個元素將保留在由線粒體輸入失敗引起的真正錯定位的蛋白質中。為研究含序列Cit1的穩定性,作者使用一個tom40-97溫度敏感突變體(圖5A,右)。當Cit1在tom40-97細胞中過表達時,preCit1會積累(圖5B,lane1),并隨著時間的推移而降解(lane 1-4)由于對該菌株進行遺傳操作的未知難度,作者發現preCit1-ds/AA是穩定的(圖5B,lane 5-12),這表明preCit1的降解取決于Ucc1。作者注意到在Tom40-97細胞中積累的Hsp60的前體形式在追趕期保持不變(圖5B)。這一觀察強調前體蛋白質量控制的特異性。
接下來,作者使用這種交替系統研究積累preCit1是否也具有毒性,毒性取決于酶活性。當Cit1在GAL1啟動子的調控下過表達時,tom40-97細胞在允許溫度26℃和限制溫度35℃的條件下幾乎和含有空質粒的對照細胞一樣生長(圖5C,第6、7行)。然而,在35℃條件下,表達Cit1-DS/AA的tom40-97細胞逃避Ucc1介導的降解,生長速度比空質粒的細胞慢(圖5C第6、8行)。在半允許溫度30℃的液體培養基中生長時也觀察到類似的趨勢(圖5D-E)。通過引入消除活性(圖5C,5E)的H/G突變,消除了表達Cit1-DS/AA的tom40-97酵母的生長缺陷表型。與這些結果一致,表達Cit1-DS/AA的tom40-97細胞中檸檬酸鹽的水平高于表達Cit1或Cit1-DS/AA-H/G的tom40-97細胞(圖5F)。這一數據表明,從純內源位點表達的preCit1在導入失敗時積累在細胞質中時可以表現出酶活性。
由于Ucc1識別折疊的檸檬酸合成酶(圖1-3),非導入的preCit1被Ucc1識別并靶向降解的事實表明preCit1很可能折疊成類似于NDCit1的三維構象,在胞質中具有催化活性,盡管需要進一步的分析來充分證明preCit1在體內胞質中是否形成二聚體。preCit1-DS/AA可溶的觀察結果支持了這一觀點(圖5G)。此外,酶活性檸檬酸合成酶在胞質中的積累比在線粒體中的毒性更大(圖4)。基于這些結果,作者提出表達Cit1-DS/AA的tom40-97細胞的生長缺陷(圖5C-E)可歸因于非導入的preCit1在胞內合成檸檬酸鹽。
當這些細胞在只含有必需氨基酸的合成“最小”培養基中生長時,表達WT Cit1的細胞比表達Cit1-ds/AA的細胞表現出更低的適應度(圖5M),這表明適度的preCit1積累可以根據環境增加或降低細胞適應度。這些結果進一步支持了作者的觀點,即在導入失敗時積聚在細胞質中的preCit1表現出酶活性并影響細胞活性。
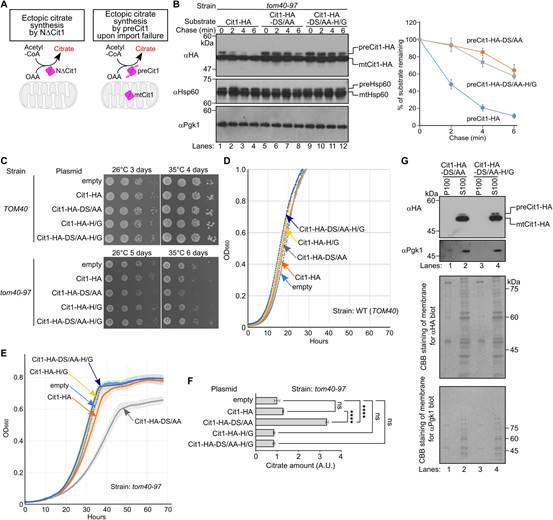
圖5 preCit1的積累以酶活性依賴的方式對細胞有毒
5、異位檸檬酸鹽合成引發代謝失衡
作者的數據表明,非輸入Cit1的異位檸檬酸鹽合成代表一種代謝擾動形式,可能模仿線粒體輸入失敗的后果。為全面評估胞質檸檬酸鹽合成對代謝的影響,作者比較表達NDCit1-DS/AA和NDCit1-DS/AA-h/G的WT細胞(圖6A)和表達Cit1的tom40-97細胞的代謝組學特征DS/AA和Cit1-DS/AA-h/G(圖6A)。為此,分別采用液相色譜-質譜法(LCMS)和離子色譜-質譜法(IC-MS)對陽離子代謝物和陰離子代謝物進行了全面定量。作者從圖4C和5F中發現,在這兩種情況下,檸檬酸鹽的積累都很明顯,導致各種代謝物的波動(圖6B)。累積的檸檬酸池的大小明顯大于TCA循環中其他有機酸的大小(圖6C)。由于檸檬酸來源于碳水化合物代謝,作者在給藥后24小時評估13C流入檸檬酸池。作者發現大量糖源性13C被納入檸檬酸池(圖6D)。基于這些結果,作者得出結論,碳水化合物的通量主要指向檸檬酸鹽池。碳水化合物池的重新連接可能會影響糖衍生的其他代謝物的產生,因為胞質檸檬酸鹽的合成擾亂了正常的碳通量,通過這種碳通量,己糖被氧化并最終在線粒體中轉化為二氧化碳。途徑分析表明,除TCA和GL外,許多氨基酸和核苷酸代謝途徑受到影響。有趣的是,在積累NDCit1的WT細胞和積累preCit1的tom40-97細胞中,觀察到天冬氨酸顯著減少,谷氨酰胺和谷氨酸顯著增加(圖6F)。由于這些氨基酸用于核苷酸的從頭合成,因此預測觀察到的氨基酸失衡會影響核酸代謝,核苷酸和脫氧核苷酸水平確實會下降(圖6G)。異位檸檬酸合成可能導致不同種類代謝物的減少和增加,破壞全球代謝平衡。
盡管如此,胞內檸檬酸的保留似乎會減弱糖基天冬氨酸的產生,而天冬氨酸缺乏可能會損害核苷酸的產生。相比之下,谷氨酸和谷氨酰胺的水平升高,支持了這一解釋。因此,胞質檸檬酸鹽合成可能通過碳通量從糖轉移而導致氨基酸失衡和嘌呤/嘧啶核苷酸減少(圖6H)。
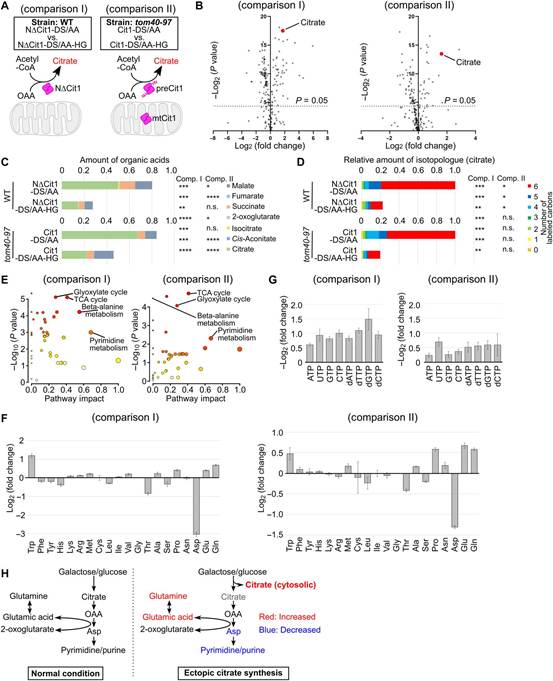
圖6 異位檸檬酸鹽合成引發代謝失衡
為廣泛地研究細胞對異位檸檬酸合成的反應,作者對表達NDCit1-DS/AA或NDCit1-DS/AA-H/G的細胞進行了轉錄組分析,發現胞質中檸檬酸的合成改變超過2600個編碼基因的轉錄本水平。編碼翻譯、核糖體生物合成、核糖體RNA加工和核糖體組裝的mRNA顯著下調(圖7A)。因此,作者進行嘌呤霉素摻入實驗來直接評估翻譯效率。嘌呤霉素是一種鏈終止劑,嵌入生長的新生多肽鏈中,可以使用抗嘌呤霉素抗體進行WB檢測。表達NDCit1-DS/AA(圖7B,lane 2)的細胞嘌呤霉素摻入效率低于表達NDCit1-DS/AA-H/G的細胞(lane 4)。用放線菌酮預處理細胞阻斷嘌呤霉素摻入(lane 1,3),證實新合成蛋白的檢測。這一結果表明胞質檸檬酸的合成降低了翻譯效率。為證實這一發現,作者還進行多聚體分離實驗,其中檢測到單聚體和多聚核糖體的相對含量。作者發現在表達NDCit1-DS/AA的細胞中,相對單體多聚體比例高于表達NDCit1-DS/AA-H/G的細胞(圖7C)。
最后,作者檢測翻譯抑制是否在緩解細胞功能障礙中發揮保護作用。為此,作者刪除了產物具有部分重疊功能的DOT6和TOD6基因,以抑制雷帕霉素靶蛋白復合體1和環磷酸腺苷依賴的蛋白激酶通路下游的核糖體生物合成基因的表達。如圖7D所示,如前所述,NDCit1-DS/AA的過表達減緩了WT細胞以及dot6D細胞和tod6D細胞的生長(圖4B)。當DOT6和TOD6同時缺失(dot6Dtod6D)時,生長缺陷被夸大。相反,當表達H/G突變的NDCit1-DS/AA時,即使在dot6Dtod6D細胞中,細胞生長也不受影響。當在液體培養基中分析生長表型時,觀察到類似的趨勢(圖7E)。這些結果表明翻譯抑制對異位檸檬酸鹽合成有保護作用。線粒體輸入失敗不僅會引起蛋白質毒性損傷,還會引發異位代謝應激(圖7F)。
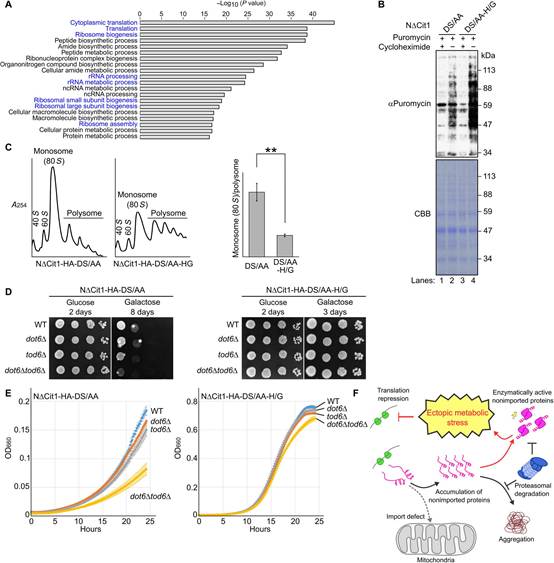
圖7 翻譯抑制保護細胞在異位檸檬酸應激
參考文獻
Nishio K, Kawarasaki T, Sugiura Y, Matsumoto S, Konoshima A, Takano Y, Hayashi M, Okumura F, Kamura T, Mizushima T, Nakatsukasa K. (2023) Defective import of mitochondrial metabolic enzyme elicits ectopic metabolic stress. Sci Adv.;9(15):eadf1956. doi: 10.1126/sciadv.adf1956.






