剩飯新炒的Stomatin依舊可以發高分
實驗方法:細胞培養及誘導成脂分化,BSA偶聯棕櫚酸的制備與處理,慢病毒包裝和感染,脂質滴分離,脂質積累定量,WB,免疫熒光(IF),免疫共沉淀(IP),脂質組學分析,熒光漂白恢復(FRAP)實驗,細胞表面生物素化,鄰位連接技術(PLA),脂肪酸攝取實驗,轉基因小鼠構建,小鼠表型分析,葡萄糖耐量試驗,病理學分析,轉錄組測序
脂肪酸攝取、脂質產生和儲存以及脂滴代謝的調節與脂質穩態、脂肪細胞肥大和肥胖密切相關。本文發現stomatin是脂筏的主要成分,通過調節相關信號通路參與脂肪生成和脂肪細胞成熟;在脂肪細胞樣細胞中,增加的stomatin通過促進LD-LD融合來促進LD的生長或擴大;stomatin還通過將效應分子(如FAT/CD36易位酶)募集到脂筏中來促進脂肪酸的內化,從而促進脂肪酸從細胞外環境中的攝取。高脂飲食喂食(HFD)的氣孔蛋白轉基因小鼠表現出肥胖、胰島素抵抗和肝臟損傷;然而,在用常規飲食喂養的轉基因動物中沒有觀察到這種表型;通過基因敲低或OB-1抑制stomatin通過下調PPARγ途徑抑制脂肪分化和LD生長;stomatin對PPARγ的影響涉及ERK信號傳導;然而,也可能存在其余途徑。本研究于2022年7月發表在《Nature Communications》IF:17.694期刊。
技術路線:

主要實驗結果:
1、脂肪形成過程中stomatin表達增加
為探究脂肪細胞分化,建立細胞模型:MD處理小鼠3T3-L1成纖維細胞3天,隨后胰島素處理第3 ~ 7天,使這些細胞分化為脂肪細胞樣細胞,油紅O染色可觀察到細胞內脂質沉積(圖1a)。這些細胞表達stomatin和主要脂肪細胞基因,如PPARγ,C/EBPα,Perilipin(圖1b)。在第7天,這些脂肪樣細胞中在DIC顯微鏡下可觀察到大的脂質滴(LD);免疫熒光染色顯示stomatin的亞細胞分布,除了細胞質中的點狀染色外,在質膜(箭頭所示)以及LD的表面也可見stomatin蛋白(圖1c)。在STED顯微鏡下檢查時,stomatin部分地與周圍磷脂蛋白共定位(圖1d)。當從脂肪樣細胞中分離出LD時,LD中存在stomatin以及已知的LD相關蛋白磷脂蛋白(圖1e)。
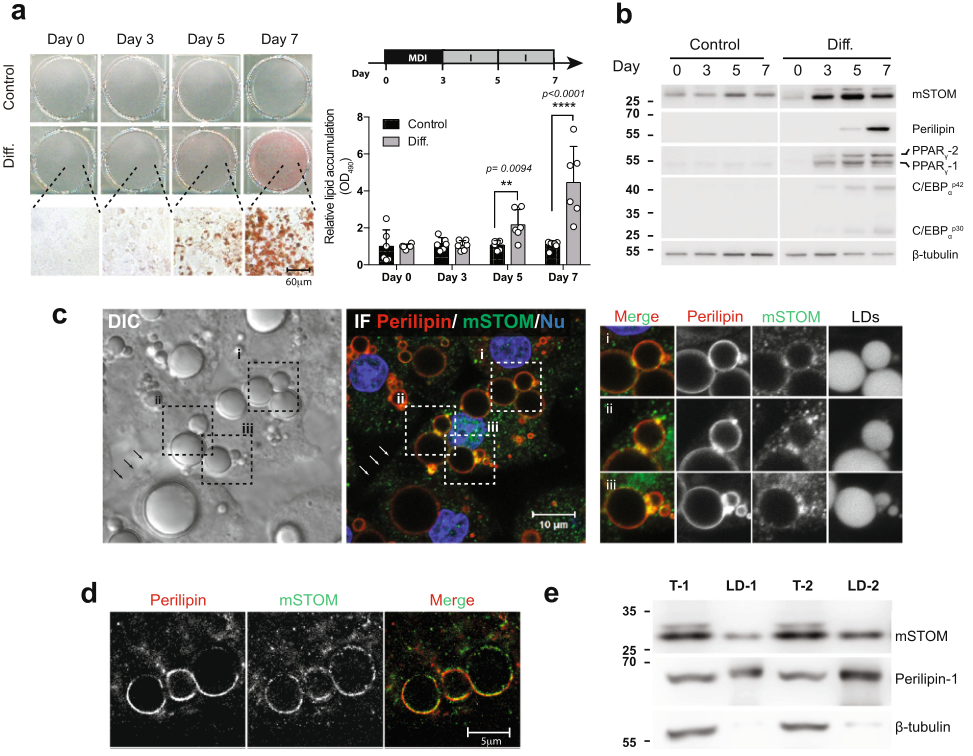
圖1 在脂肪形成過程中,stomatin表達增加
2、高水平的stomatin促進LD增大
在小鼠3T3-L1細胞中過表達人stomatin基因(hSTOM),這些細胞被誘導分化為脂肪樣細胞,結果顯示過表達stomatin不影響脂肪分化,通過比較脂質積累(圖2a)和脂肪基因的表達(圖2b)。通過測定單個LD的大小,發現stomatin過表達細胞中LD更大(圖2c)。通過兩個小LD的融合可以形成一個大LD。延時記錄表明在過度表達stomatin的脂肪細胞樣細胞中存在這樣的LD-LD融合事件(圖2d)。
或者,大的LD可能是由較小的LD囊泡逐步“填充”脂質含量導致的,有些在光學顯微鏡下看不清。作者利用FRAP實驗來研究這種可能性。如圖2e所示,如圖2e所示,在過表達stomatin的脂肪細胞樣細胞中,LD的光漂白熒光含量導致了更快的熒光恢復(綠色,頂部痕跡),相比之下,對照細胞的熒光恢復要少得多、慢得多(藍色,底部痕跡)。
在體外測量LD-LD融合事件(圖2f,g)。從細胞中分離出LD,其LD被加載綠色Bodipy-FL-C16或紅色Bodipy-558/568-C12熒光標記的脂肪酸類似物(箭頭,圖2g)。一些LD在體外混合時,似乎發生了融合,形成了黃色的LD(箭頭,圖2g),因為它們同時含有熒光的脂肪酸類似物。LD-LD融合的程度可以通過計算融合的LD百分比來量化。由于stomatin可以分泌到培養基中,作者注意到,與從對照組細胞收獲的條件培養基(CM-Ctl)相比,添加從過表達stomatin的細胞中獲得的條件培養基(CM-hSTOM)會導致融合的LDs百分比增加。有趣的是,通過用抗stomatin抗體處理條件培養基來消耗stomatin,有效地抑制了這種融合促進活性(圖2g)。
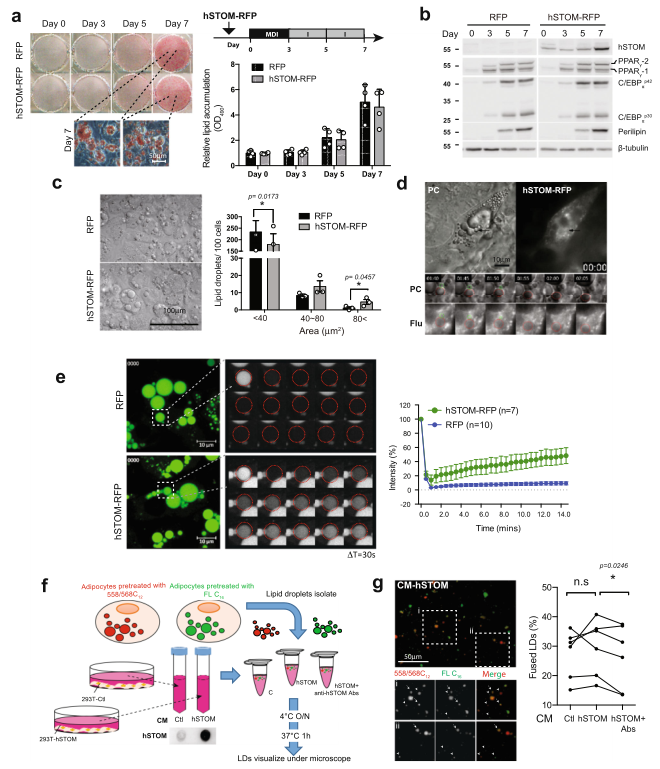
圖2 stomatin過表達促進脂肪樣細胞LD的生長和融合
3、高水平stomatin促進脂肪酸攝取并且stomatin被招募到質膜上與CD36相互作用
作者使用IP使用鑒定和stomatin結合的蛋白,共鑒定到885個候選蛋白,其中183個蛋白存在于質膜(PM),包括CD36和CAV1,它們與脂質儲存相關。免疫沉淀實驗證實stomatin與CD36的分子相互作用(圖3a)。熒光標記的棕櫚酸類似物Bodipy-FL-C16,當添加到培養基中時,被3T3-L1脂肪細胞樣細胞內化。吸收過程可以通過測量細胞內熒光的增加來持續監測(圖3b)。過表達stomatin的脂肪細胞樣細胞(綠色)比對照組細胞(藍色)表現出更多和更快的脂肪酸吸收。這樣的效果不是由擴散引起的。在過表達stomatin(灰色痕跡)和對照組脂肪細胞樣細胞(黑色痕跡)之間的Bodipy-FL攝取效率沒有發現明顯變化。
Stomatin不僅促進脂肪酸的吸收,而且在這個內化過程中從LD表面重新分布到質膜上。如圖3c所示,當用BSA作為對照處理細胞時,在被檢查的大約一半脂肪細胞樣細胞中,stomatin蛋白以高豐度存在于LD周圍。然而,當用BSA結合的棕櫚酸(PA)處理這些細胞15分鐘時,大多數與LD相關的stomatin似乎與LD "解離",出現在質膜上或分散在細胞膜上。
位于細胞表面的膜蛋白的數量可以用表面生物素化的方法進行標記,并與細胞內的蛋白分別進行量化。如圖3d所示,計算了相對于總蛋白(輸入),stomatin、CAV-1、CD36和ATP1A1的表面生物素化部分(表面)。只存在于細胞內部的肌動蛋白被用作對照。結果發現,與BSA處理相比,用PA處理細胞時,CAV-1、CD36和ATP1A1的表面部分仍然沒有變化。相反,用PA處理脂肪細胞樣細胞時,stomatin的表面部分比用BSA處理時有所增加(箭頭)。這樣的增加可能是由于PA的吸收引發了stomatin從LD或其他細胞內室被招募到質膜上,促進了來自細胞外環境的脂質成分的內化。
使用PLA進一步原位分析了stomatin和其他LD相關蛋白,如CD36或CAV-1之間的分子相互作用。如圖3e所示,當用PA處理3T3-L1脂肪細胞樣細胞時,PLA+位點顯著增加,表明stomatin和CD36之間沿質膜分子結合(箭頭)。撤消PA處理可以逆轉這種stomatin-CD36的相互作用。相反,PA處理并不影響stomatin和CAV-1之間的相互作用(圖3f)。
以上表明STOM招募到質膜上并與CD36相互作用
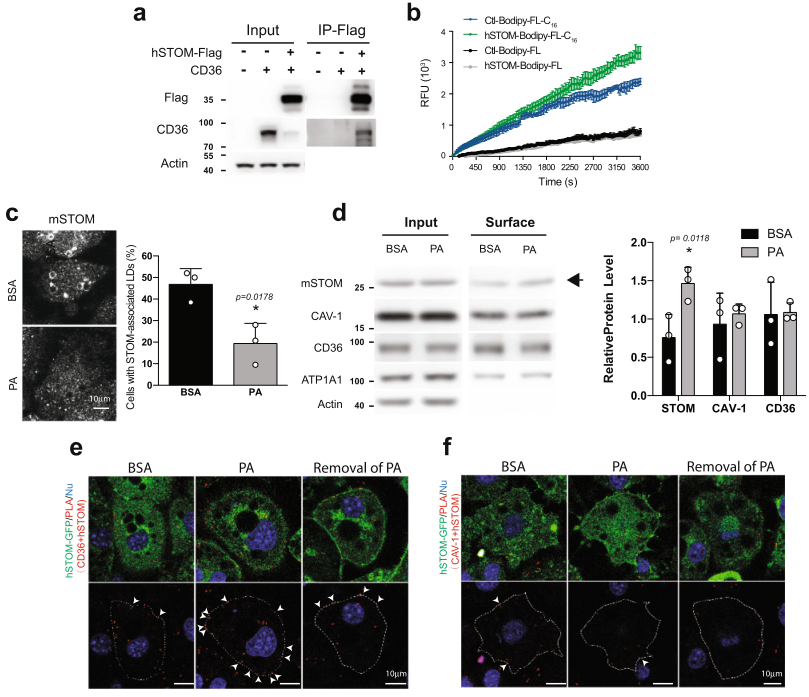
圖3 stomatin與CD36互作促進脂肪酸攝取
4、STOM升高導致喂HFD小鼠肥胖
研究飲食對stomatin表達的影響。野生型小鼠(WT)用普通飼料(CD)或高脂肪飲食(HFD)喂養20周。收集脂肪墊,并通過qPCR檢測stomatin(圖4a)。與CD喂養的小鼠相比,HFD喂養的小鼠皮下(SAT)和內臟(VAT)白色脂肪組織中mSTOM的mRNA增加,但這種增加在棕色脂肪組織(BAT)中不太明顯。
STOM轉基因(STOM Tg)小鼠是通過將人類stomatin基因工程到動物體內產生的。這些小鼠在SAT中含有大量的hSTOM蛋白(圖4b),這些蛋白主要在白色脂肪細胞的表面膜上(圖4c)。STOM Tg和對照組WT小鼠自3周歲起用CD或HFD喂養20周;每周對它們進行稱重(圖4d)。當用CD喂養時,STOM Tg與WT小鼠的體重增加相似。然而,當用HFD喂養時,STOM Tg小鼠比WT更快地增加體重(圖4d,e)。在HFD喂養20周后,STOM Tg小鼠的體重比WT小鼠至少高17%。全身成分測量顯示,脂肪的增加比瘦肉、自由液體或總水的增加更明顯(平均增加32%)(圖4f)。
體內脂肪酸攝取實驗是通過將BSA乳化的Bodipy-FL-C16注射到小鼠的尾靜脈,孵化15分鐘,然后測量動物白色脂肪組織中的熒光信號(圖4g)。觀察到到STOM Tg小鼠比WT小鼠有更多的脂肪酸吸收到脂肪組織中(圖4g)。
以上表明,在體內stomatin轉基因小鼠脂肪攝取更多更快,小鼠更肥胖。
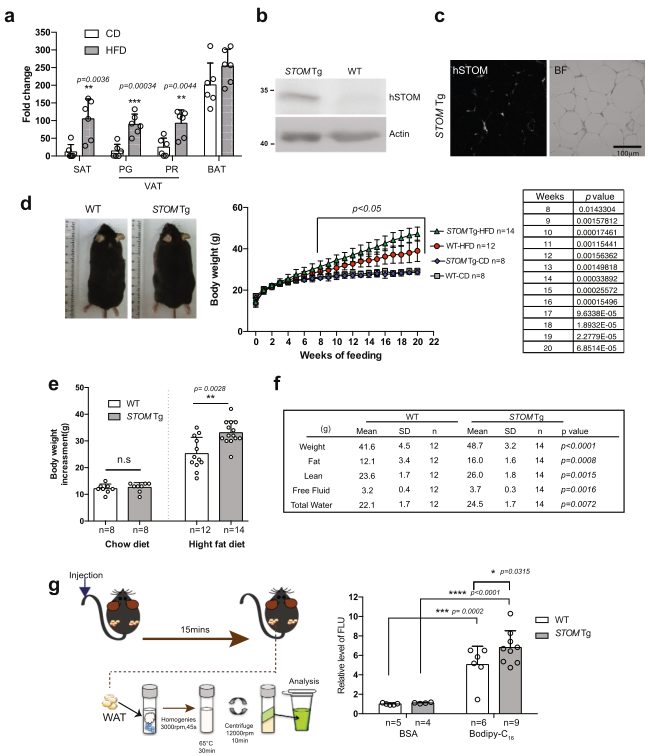
圖4相比于對照小鼠高脂飲食喂養的stomatin轉基因小鼠更加肥胖
5、HFD喂養stomatin轉基因小鼠脂肪細胞肥大與代謝紊亂
經過20周的HFD喂養,具有上調stomatin的小鼠顯示出比WT小鼠更多的SAT和BAT的質量,而他們的VAT組織相對保持不變(圖5a)。組織學分析顯示,在HFD喂養的STOM Tg小鼠中,SAT的脂肪細胞出現肥大,并且比WT小鼠的脂肪細胞大小更大(圖5b)。如圖5c所示,雖然STOM Tg和WT小鼠的空腹血糖水平相似,但通過HOMA-IR實驗測得的血漿胰島素和胰島素抵抗明顯升高,通過腹腔葡萄糖耐量試驗(IPTGG)測得的葡萄糖耐量在HFD喂養的STOM Tg比對照組小鼠更難耐受。肥胖通常與肝臟中的異位脂肪堆積有關。事實上,HFD喂養的STOM Tg小鼠表現出更大的肝臟質量(肝臟腫大),以及大泡和小泡的脂肪變性。這些表型與肝功能受損有關,血清中GPT和GOP水平的升高就是證明(圖5d)。

圖5 高脂飲食喂養的stomatin轉基因小鼠表現出脂肪細胞肥大與代謝紊亂
6、敲低STOM阻斷脂肪生成和LD變大
將兩種針對小鼠stomatin基因不同位點的shRNA分別包裝在慢病毒顆粒中并導入3T3-L1細胞,得到shSTOM-1和shSTOM-2細胞。兩種shRNAs都能有效地下調stomatin的表達。敲除stomatin抑制了脂肪生成,這一點從誘導分化后缺乏脂質積累得到證明(圖6a)。參與脂肪細胞分化的基因的表達,如PPARγ和C/EBPα,因stomatin敲除而減少(圖6b)。STOM的下調也抑制了LD的成熟和生長(圖6c)。
比較stomatin敲低和對照組3T3-L1脂肪細胞樣細胞的轉錄組譜。共鑒定到379個轉錄物有顯著差異,包括185個上調的基因和194個下調的基因。使用轉錄組分析控制臺(TAC)將這些基因映射到128條Wikipathways上,排名靠前的富集途徑如圖6d示。在"脂肪生成基因 "通路中,涉及該通路的12個基因顯著差異,其中9個(75%)被下調,3個(25%)被上調(圖6e)。為進一步驗證芯片結果,進行qPCR實驗,重點是脂肪生成相關基因Pparg、Cebpa、Dlk-1、Fabp4和Cfd基因(圖6f);除了Dlk-1,所有這些基因都被下調了。

圖6降低stomatin表達影響脂肪生成并抑制脂滴生長
7、STOM通過ERK通路調節脂肪形成
如圖7a所示,敲除stomatin導致PPARγ的減少。Akt途徑沒有受到STOM敲除的影響,而ERK途徑被激活(箭頭)。脂肪生成基因C/EBPβ和C/EBPδ是PPARγ調節的上游。在誘導脂肪生成分化后,C/EBPβ和C/EBPδ,在前三天表現出短暫的增加,隨后從第三天到第七天逐漸減少(圖7b-c)。在stomatin敲除的3T3-L1脂肪細胞樣細胞中,發現stomatin的缺乏在第7天引起C/EBPβ的減少(圖7b)。相比之下,stomatin敲除能夠維持或增加C/EBPδ的表達,使之達到比對照組高得多的水平(圖7c)。
ERK途徑的激活已被證明可抑制PPARγ,從而禁止脂肪細胞的分化和脂肪生成。U0126是一種高度選擇性的ERK抑制劑。用U0126處理shSTOM-1脂肪細胞樣細胞,理論上U0126可能減輕stomatin敲低對pERK激活的影響。然而,U0126處理并沒有扭轉hSTOM-1細胞的脂質積累不足的表型(圖7d)。相反,用PPARγ激動劑TGZ處理shSTOM-1細胞,能夠部分挽救脂質積累缺陷;有趣的是,U0126和TGZ的雙重處理可以進一步促進脂質積累(圖7e)。這些結果表明,stomatin存在一種目前未知的機制,可以正向調節PPARγ并激活脂肪生成,而不依賴于ERK。

圖7 敲低Stomatin激活ERK通路
Stomatin的功能抑制可以通過藥理試劑OB-138實現,該試劑通過干擾Stomatin的自我結合,抑制Stomatin的活性。首先確定了OB-1的LD50(圖8a)。用OB-1處理3T3-L1脂肪細胞樣細胞,以劑量依賴的方式有效減少了脂質積累(圖8b)。OB-1處理后,LD的大小也減少(圖8c),磷酸化ERK的水平增加(圖8d)。
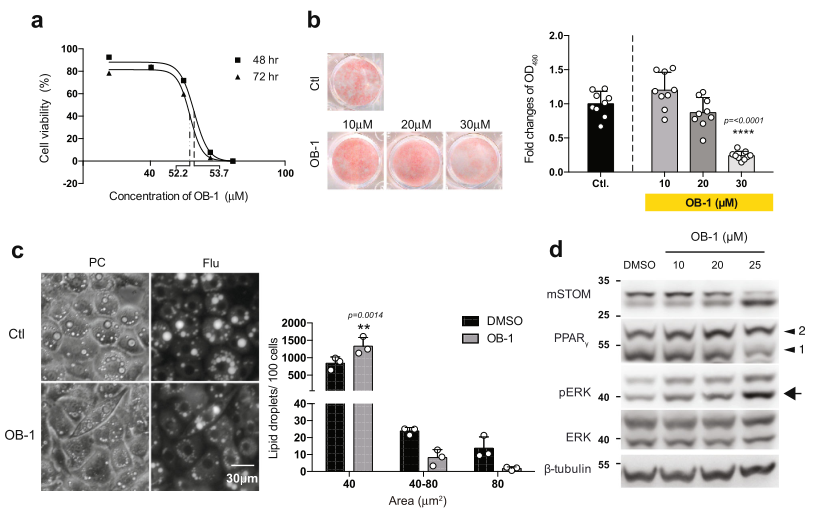
圖8 Stomatin抑制劑OB-1抑制脂肪生成,阻礙脂滴生長
總之,提出了stomatin在調節成脂分化和調節LD生長和脂肪細胞攝取脂肪酸中的作用的工作模型(圖9a)。
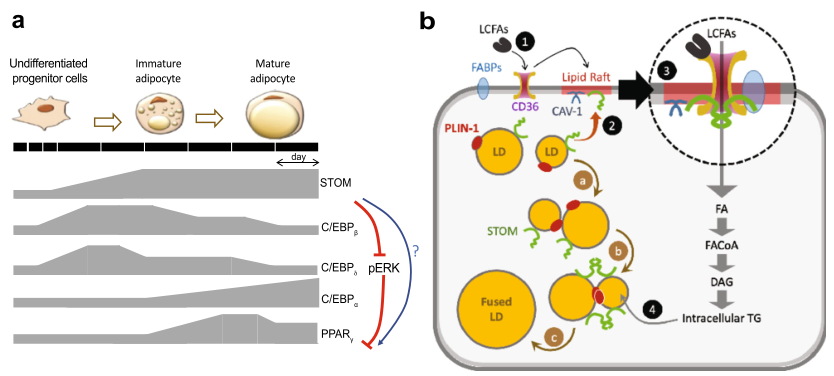
圖9圖解模型說明了誘導成脂分化過程中動態基因表達和stomatin在促進脂肪細胞脂肪酸攝取和脂滴增大中的作用
參考文獻:
Wu SC, Lo YM, Lee JH, Chen CY, Chen TW, Liu HW, Lian WN, Hua K, Liao CC, Lin WJ, Yang CY, Tung CY, Lin CH. Stomatin modulates adipogenesis through the ERK pathway and regulates fatty acid uptake and lipid droplet growth. Nat Commun. 2022 Jul 19;13(1):4174. doi: 10.1038/s41467-022-31825-z. PMID: 35854007






