泛癌tRNA 衍生片段CAT1協調RBPMS穩定NOTCH2 mRNA促進腫瘤發生

轉運核糖核酸衍生片段(tRFs)是一類小非編碼調控RNAs,與許多疾病的病理生理學有關。然而,tRFs 在癌癥進展中的作用在很大程度上仍然難以捉摸。本研究證明泛癌癥3′-tRF CAT1(癌癥相關tRF 1)在腫瘤中普遍上調,并與包括肺癌在內的多種癌癥的不良預后相關。機制上,癌細胞中上調的CAT1與具有多重剪接功能的 RNA 結合蛋白(RBPMS)結合,取代NOTCH2與RBPMS 的聯系,從而抑制隨后由CCR4-NOT脫腺苷化復合物介導的NOTCH2 mRNA衰減。該研究于2023年8月發表在《Cell Reports》,IF:8.8。
技術路線
主要研究結果
1. 泛癌CAT1上調促進腫瘤細胞增殖和侵襲,與癌癥患者預后不良相關
為確定CAT1在腫瘤發病機制中的確切作用,分析小RNA測序(RNA-seq)數據,結果表明CAT1是一個18-nt的3′-tRF,它是由攜帶對應于氨基酸L-丙氨酸的反密碼子AGC(即tRNA-Ala-AGC-1-1)的only tRNA isodecoder的TψC環切割產生的(圖1A,右)。dumbbell-聚合酶鏈反應(Db-PCR)產物的Sanger測序驗證腫瘤標本中CAT1的18-nt序列(圖1A,左),Db-PCR是一種改良的TaqMan實時qPCR方法,可以單堿基分辨率對RNA片段的5?和3?端變異體進行特異性定量(圖1A,左)。對TCGA數據集的分析表明,CAT1在許多類型的腫瘤組織中顯著上調(圖1B)。值得注意的是,其高表達強烈預測各種癌癥類型患者的短生存期(圖1C)。與此一致,對一組獨立的癌癥標本進行的Db-PCR分析證實,與健康標本相比,CAT1在大多數癌癥類型中高度豐富,且表達上調(圖1D)。鑒于非小細胞肺癌(NSCLC)是全球癌癥相關死亡率的主要原因,因此選擇肺癌細胞系(A549和Calu1)作為評估CAT1在癌癥中的功能的主要模型。正如預期的那樣,CAT1不僅在肺癌組織中上調(圖1B和1D),而且其高表達還與較差的預后相關。值得注意的是,對30例NSCLC患者和25例健康對照者血漿標本的Db-PCR分析表明,CAT1在肺癌患者血漿中的表達顯著且持續高于健康對照者(圖1E)。綜上所述,這些結果表明CAT1在癌組織和NSCLC患者血漿中高表達,并與不良預后相關。CAT1敲低降低肺癌細胞的增殖(圖1F)、遷移(圖1G)和侵襲(圖1G)。此外,CAT1敲除誘導G1期阻滯(圖1H)。
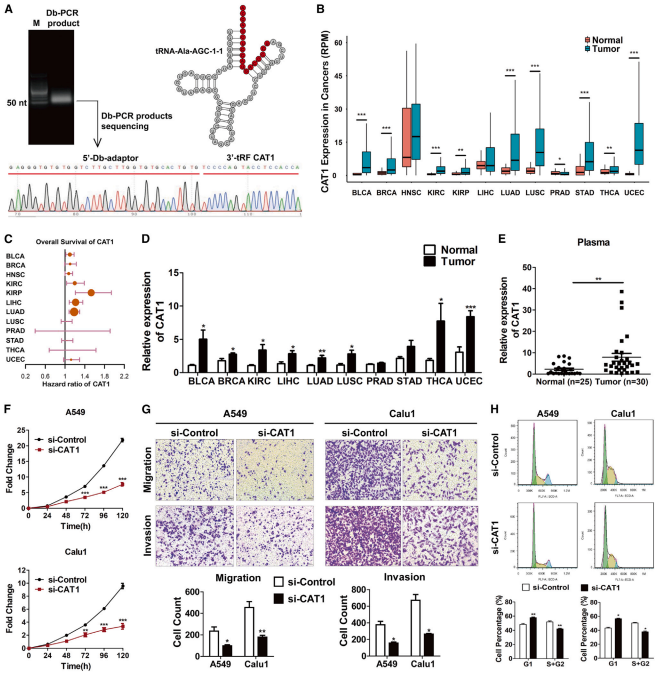
圖1. 泛癌CAT1上調促進腫瘤細胞增殖和侵襲,與癌癥患者預后不良相關
2. CAT1和RBPMS通過相互作用協調調節mRNA的表達
為闡明CAT1調控癌細胞的機制,使用合成的3′-生物素化CAT1在A549細胞中進行RNA pull-down實驗。免疫印跡分析表明RBPMS是一種相關蛋白,而CAT1反義鏈未與RBPMS結合(圖2A)。同樣,在A549細胞中使用抗RBPMS抗體進行的RNA免疫沉淀(RIP)檢測證實,RBPMS與CAT1結合,但未與其他tRFs結合,如5′-IleAAT-8-1-L20 (Ile-20,陰性對照)(圖2B)。CAT1在3′末端含有CAC RRE,RNA下拉實驗表明,含有GGG取代CAC的CAT1突變體降低CAT1與RBPMS的結合(圖2C)。與這一發現一致,缺失RRM結構域的RBPMS突變體失去與CAT1的關聯(圖2D)。這些結果表明CAT1與RBPMS蛋白的相互結合依賴于CAT1中的CAC RRE被RBPMS的RRM結構域識別。利用RNA-seq對CAT1敲低(圖2E)和RBPMS敲除細胞進行無偏轉錄組分析(圖2F)。這項分析顯示,5,873個基因在CAT1敲低時發生改變,3,777個基因在RBPMS敲低時發生改變,其中1,321個基因在RBPMS敲低細胞和CAT1敲低細胞中同時發生改變(圖2G)。觀察到的1,321個改變基因的數量顯著高于在RBPMS敲除和CAT1敲除細胞中偶然同時發生的改變基因的數量(p=1.06E71),表明CAT1和RBPMS協同調節一些改變基因的表達。此外,RBPMS-RIP-seq顯示,1,741個包含CAC RREs的基因與RBPMS結合,其中176個與RBPMS和CAT1可能共同調節的1,321個基因重疊(圖2G)。然后對這176個基因進行GO富集分析,發現其中25個基因與細胞周期調控相關,這與CAT1對腫瘤細胞周期進程的強調控(圖1H)很好地吻合。對這些驗證基因的FLAG-RBPMS-RIP分析顯示,除LIG4外,其他8個基因與RBPMS相關,但與RRM截短突變體無關,其中相對富集度最高的是NOTCH2(圖2H)。這些結果表明,CAT1和RBPMS通過相互作用協同調節包括NOTCH2在內的mRNA的表達。
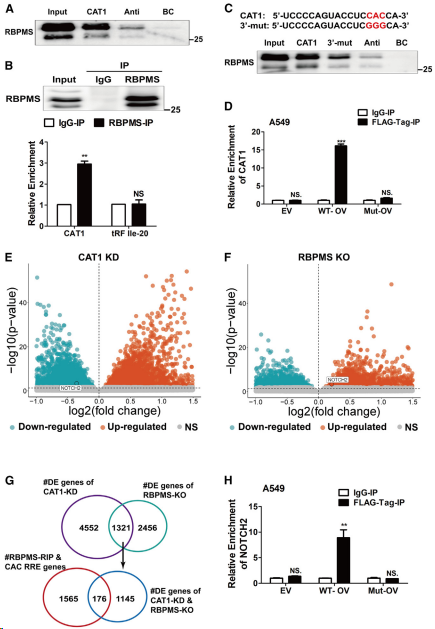
圖2. CAT1和RBPMS通過相互作用協調調節mRNA的表達
3. CAT1與RBPMS結合抑制CCR4-NOT脫腺苷化復合物介導的NOTCH2 mRNA衰減
NOTCH2在腫瘤中常被過度表達或突變,可上調CCND1的表達并調節細胞周期在G0/G1期和細胞增殖。使用抗RBPMS抗體對A549細胞進行RIP分析,結果表明,CAT1的過表達(與RBPMS呈劑量依賴性結合)(圖3A)以CAT1表達依賴性的方式降低RBPMS相關NOTCH2 mRNA的富集(圖3B),同時細胞NOTCH2 mRNA總表達相應增加(圖3C)。此外,對轉錄的Notch胞內結構域(NICD) RNA進行的電泳遷移率變化分析(EMSA)表明,純化的RBPMS與合成的3′-生物素化CAT1結合,并且這種結合以依賴于NICD RNA劑量的方式減少(圖3D)。這些結果表明CAT1和NOTCH2 mRNA競爭性結合RBPMS,并且CAT1與RBPMS的結合取代NOTCH2 mRNA與RBPMS的結合。值得注意的是,在用Dactinomycin處理的肺癌細胞中敲低CAT1,抑制重新轉錄,從而消除轉錄調控的作用,使NOTCH2 mRNA的半衰期縮短(圖3E),而過表達CAT1(圖3F)或去除RBPMS(圖3G)則延長NOTCH2 mRNA的半衰期。重要的是,CNOT1敲低挽救了CAT1敲低引起的NOTCH2半衰期縮短(圖3H、3I)。與這些發現一致,通過siRNA(圖3J和3K)敲除CAT1降低NOTCH2的mRNA和蛋白水平,而這種降低可通過敲除RBPMS(圖3L和3M)或CNOT1(圖3N和3I)來消除。相反,CAT1過表達(圖3C)或RBPMS敲低(圖3O和3P)增加NOTCH2 mRNA和蛋白的表達。接下來研究CAT1和RBPMS對notch2介導的CCND1、CDK4和EMT標志物表達的調節作用,結果表明,敲除RBPMS(圖3P)增加了這些蛋白的表達,并且敲除RBPMS可消除CAT1誘導的減少(圖3M)。總之,這些結果表明,CAT1與RBPMS的結合減弱了RBPMS與NOTCH2 mRNA關聯,并抑制隨后CCR4-NOT脫腺苷化復合物介導的NOTCH2 mRNA衰變,從而上調NOTCH2的表達
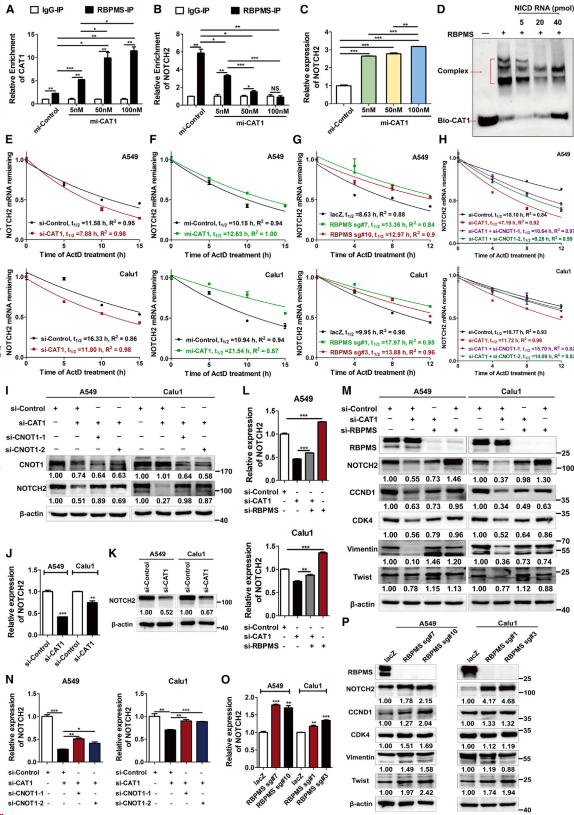
圖3. CAT1與RBPMS結合抑制CCR4-NOT脫腺苷化復合物介導的NOTCH2 mRNA衰減
4. CAT1通過上調NOTCH2表達促進細胞周期進程和細胞增殖
接下來檢測CAT1介導的和RBPMS以及CNOT1依賴的NOTCH2上調對細胞增殖和侵襲的影響。發現,NOTCH2過表達恢復CAT1缺失誘導的G1期阻滯(圖4A)以及肺癌細胞增殖(圖4B)、遷移和侵襲(圖4C)的減少。通過過表達NOTCH2, CAT1敲低抑制的CCND1和CDK4以及EMT標志物的相應表達水平也中度恢復(圖4D)。相反,CAT1過表達促進從G1期向S期(G1/S)的轉變(圖4E)、細胞增殖(圖4F)、遷移和侵襲(圖4G)。同樣,NOTCH2敲低后,CAT1過表達引起的CCND1和CDK4以及EMT標志物水平升高有所降低(圖4H)。這些數據表明CAT1通過抑制RBPMS/ CCR4-NOTCH2介導的NOTCH2 mRNA的衰減促進肺癌細胞周期進程以及增殖和侵襲。
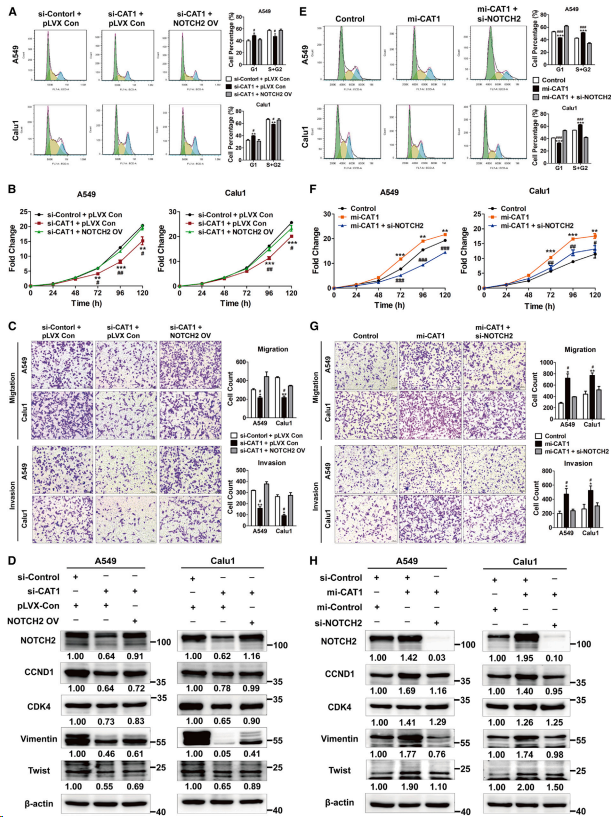
圖4. CAT1通過上調NOTCH2表達促進細胞周期進程和細胞增殖
5. CAT1通過上調NOTCH2促進小鼠腫瘤生長和轉移
將敲除CAT1的A549細胞接種于BALB/c裸鼠皮下,觀察CAT1在A549細胞成瘤中的作用。CAT1缺失顯著減小腫瘤大小(圖5A)、體積(圖5B)和重量(圖5C)。將CAT1敲除后表達熒光素酶報告基因的Calu1細胞尾靜脈注射至裸鼠體內。生物發光成像顯示,CAT1敲除大大降低小鼠轉移性肺腫瘤的生長(圖5D)和肺轉移結節的數量(圖5E)。Calu1細胞中CAT1過表達顯著增加腫瘤大小(圖5F)、體積(圖5G)、重量(圖5H),而這種增加被NOTCH2敲除抑制(圖5F - 5H)。對腫瘤組織的實時qPCR和免疫組化分析表明,CAT1敲除降低NOTCH2 mRNA表達(圖5I),相應降低NOTCH2蛋白水平(圖5J)。相反,CAT1過表達增強腫瘤組織中NOTCH2 mRNA表達(圖5K),相應增加NOTCH2蛋白水平(圖5L),而這種增加被NOTCH2敲除消除(圖5K和5L)。這些數據表明CAT1通過上調NOTCH2促進小鼠腫瘤的生長和轉移。
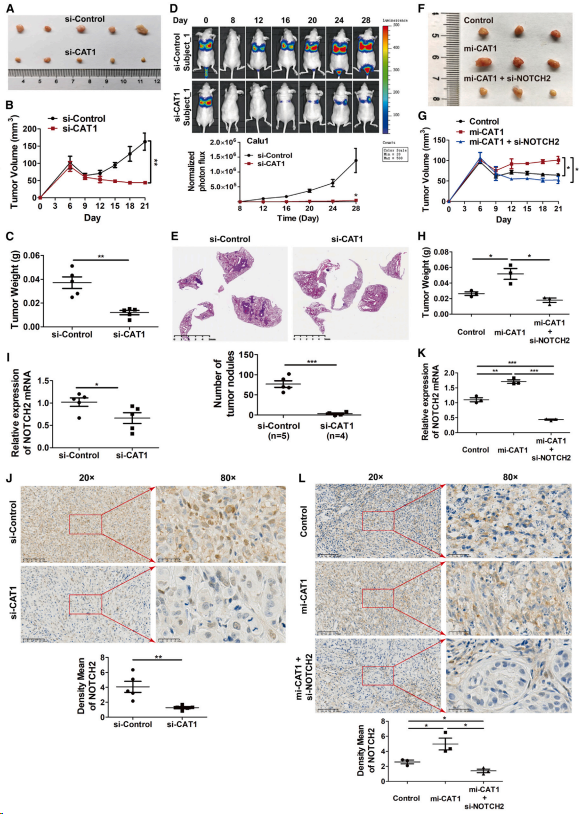
圖5. CAT1通過上調NOTCH2促進小鼠腫瘤生長和轉移
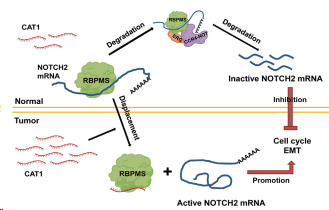
圖6. CAT1介導的腫瘤生長和進展調節示意圖
結論
綜上所述,本研究證明泛癌3′-tRF,CAT1,在腫瘤中普遍上調,并與包括肺癌在內的多種癌癥的不良預后相關。揭示了癌癥特異性CAT1上調與癌癥進展之間的內在聯系,顯示了3′-tRF對癌癥中NOTCH信號轉導的調控,并凸顯了其巨大的臨床潛力。
實驗方法
細胞轉染,用CRISPR/Cas9生成基因敲除細胞系,細胞增殖實驗,體外遷移及侵襲試驗,細胞周期分析,RNA提取及實時熒光定量PCR分析,血漿RNA提取,tRF的Dumbbell-PCR,四葉草RT-qPCR檢測成熟tRNA,WB,Northern blot,RNA pull-down,RIP,Co-IP,體外轉錄實驗,EMSA,RNA穩定性實驗,雙熒光素酶報告實驗,基因過表達,免疫組化,RNA-seq和數據分析,動物實驗
參考文獻
Yu M, Yi J, Qiu Q, Yao D, Li J, Yang J, Mi C, Zhou L, Lu B, Lu W, Ying K, Chen W, Chen E, Zhang H, Lu Z, Lu Y, Liu P. Pan-cancer tRNA-derived fragment CAT1 coordinates RBPMS to stabilize NOTCH2 mRNA to promote tumorigenesis. Cell Rep. 2023 Nov 8;42(11):113408. doi: 10.1016/j.celrep.2023.113408. Epub ahead of print. PMID: 37943661.






