驚人的多層次蛋白組學發高分
彌漫型胃癌(DGC)和腸型胃癌(IGC)是胃癌(GC)的主要組織學類型。目前對DGC和IGC差異的分子機制了解甚少。在這項研究中,進行了包括蛋白質組、磷酸蛋白質組和轉錄因子(TF)活性分析在內的多層次蛋白質組學研究,涵蓋了196例中國患者的DGC和IGC病例。綜合蛋白質組學分析揭示了與DGC和IGC之間相反預后效果相關的ARIDIA突變,通過對它們相應蛋白質組的多樣影響。系統比較和共識聚類分析分別基于細胞周期、細胞外基質組織以及免疫應答相關蛋白質表達的不同模式,確定了DGC和IGC的三個亞型。基于TF活性的亞型表明,DGC和IGC的疾病進展受SWI/SNF和NFKB復合物的調節。此外,推斷的免疫細胞浸潤和免疫聚類顯示Th1/Th2比例是免疫治療有效性的指標,在一個獨立的GC抗PD1治療患者組中得到驗證。本研究的多層次蛋白質組學分析有助于更全面地理解GC,并能進一步推動精準醫學的發展。本文于2023年2月發表在《nature communications》IF:16.6期刊上。
技術路線:

主要實驗結果:
1、胃癌隊列的全面蛋白質組學景觀
本研究收集了196對原發性胃癌樣本(DGC,n=83;IGC,n=102;混合型胃癌(MGC),n=11),以及來自未接受治療的中國患者的正常對照組(NATs)。實驗設計的示意圖如圖1a所示。多層次蛋白質組學數據使大家能夠全面探索胃癌組織與正常對照組之間蛋白質表達的變化。蛋白質組的基因集富集分析(GSEA)表明,在腫瘤組織中,與DNA復制、細胞周期、細胞外基質組織和免疫應答相關的蛋白質明顯上調,而與代謝(如脂肪酸β氧化、三羧酸循環(TCA)和氧化磷酸化)相關的蛋白質在腫瘤組織中明顯下調(圖1b)。轉錄因子活性分析的通路富集分析表明,在腫瘤組織中上調的轉錄因子涉及介導細胞周期、NF-κB信號通路和Ras信號通路,而在正常對照組中上調的轉錄因子涉及鈣信號通路、葡萄糖素信號通路和cAMP信號通路(圖1b)。磷酸蛋白質組的通路富集分析表明,腫瘤磷酸化蛋白涉及癌變相關的通路/過程,如細胞周期、TP53活性調控和DNA修復等,而正常對照組的磷酸化蛋白涉及生理功能,如囊泡介導運輸、膜運輸和葡萄糖代謝等(圖1b)。這些分析表明,腫瘤組織在蛋白質組、轉錄因子活性和磷酸蛋白質組水平上的特征顯示部分一致性,同時存在一些差異。
值得注意的是,所有三個數據集中涉及細胞周期的蛋白質均呈上調狀態。細胞周期蛋白質的評估基于它們的變化表達模式(WAPAL、AHCTF1等)、磷酸化模式(CCNL1 T67、SMC4 S41等)和在胃癌腫瘤組織中推斷的轉錄因子活性(SMARCA5、E2F3等)(圖1c)。根據蛋白質組學特征比較了轉錄因子(TFs)的靶基因(TGs)在腫瘤組織和正常對照組中的表達。如圖1d所示,TF-TG調控網絡表明TGs的表達水平呈現出與組織特異性TFs相似的趨勢。
為了探索激酶在胃癌中的作用,選擇了在腫瘤組織和正常對照組之間表達變化較大的磷酸位點,而不同于其蛋白質表達變化。胃癌相關磷酸位點的激酶底物富集分析(KSEA)確定了多個激酶,包括CDK1、CDK2、CSNK2A1、CAMK2A、PAK1、MAPK1和MAPK3,在胃癌腫瘤組織中被激活(圖1e)。這些激酶調節細胞周期以及GPCR信號通路和MAPK信號通路等多個致癌通路。進一步的研究發現,MAPK1、MAPK3和CDK1的表達、磷酸化和活性均有所增加;因此,這三個激酶可能成為胃癌患者的潛在藥物靶點(圖1f)。
因此,本研究迄今為止建立了中國胃癌患者的全面蛋白質組學景觀。此外,這些數據集可作為一個多層次的資源,用于研究胃癌病理學和精準醫學。
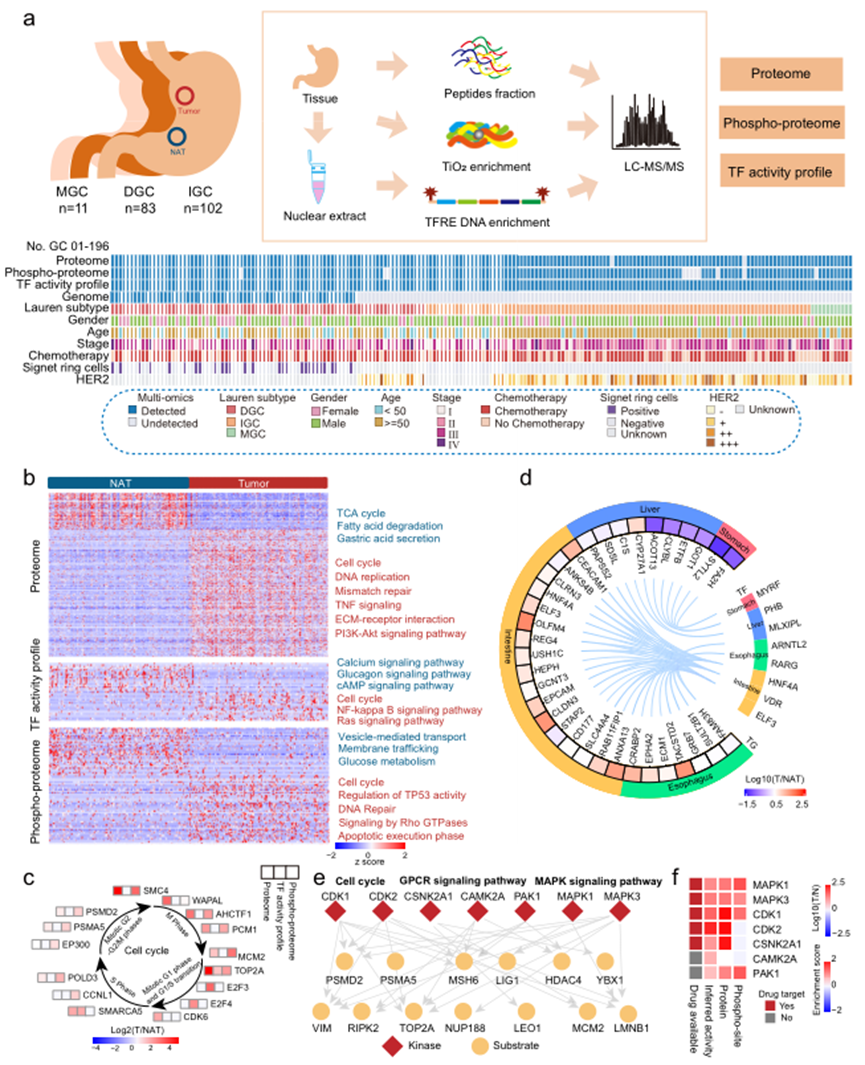
圖1 人GC樣品的多級蛋白質組學圖譜
2、ARID1A基因突變在DGC和IGC中表現出不同的影響
為研究胃癌遺傳信息的變化,對65例DGC患者中的274個癌癥驅動基因和GC熱點基因的突變頻率進行了統計分析。圖2a展示了至少有9%患者中檢測到突變的13個基因。在這些基因突變中,TP53、CDH1、KMT2D、RHOA、ARID1A、APC和PIK3CA被檢測為高頻突變(10.8-47.7%),與先前的報告一致。為了探討基因突變與預后結果的關聯,基于生存結果計算了基因突變的風險比(HR)。發現患有ARID1A突變的患者預后不利(圖2b)。
影響同一基因座位的基因表達水平的基因組變化被稱為順式效應,而影響另一基因座位的變化則被定義為反式效應。作者全面地表征了基因變化對蛋白質水平的順、反式效應(圖2c)。與順式效應相比,蛋白質豐度的變化在許多反式效應中更為顯著,并且這些變化具有生物學過程的傾向。一致地,患有CDH1突變的患者的細胞外基質蛋白質表達較低(圖2c),顯示了CDH1基因在細胞外基質組織中的功能。重要的是,只有三個基因顯示了順式效應:TP53、PIK3CA和ARID1A。患有TP53或PIK3CA突變的患者其相應蛋白質的豐度增加,而患有ARID1A突變的患者其ARID1A蛋白質表達較低(圖2d)。作者還比較了ARID1A在7例患有ARID1A突變和野生型患者中的轉錄因子活性。發現ARID1A的轉錄因子活性在患有ARID1A突變的患者中也減少了(圖2d)。這些結果表明ARID1A突變導致其蛋白質表達降低和轉錄因子活性減少。
作為唯一與不利預后相關的基因突變,作者進一步研究了ARID1A突變與癌癥蛋白質組的變化之間的關系,即相關蛋白和通路的變化。挖掘了ARID1A的TGs數據。ARID1A主要被報道為轉錄抑制因子。因此,調查了在ARID1A突變患者中升高的TGs。GSEA分析顯示在具有和不具有ARID1A突變的樣本之間存在顯著變化的通路。基于標準化富集分數,發現在ARID1A突變患者中,模式識別受體信號通路和TLR信號通路是富集最顯著的通路(圖2e–f)。在參與TLR信號通路的15個蛋白質中,CD14和PIK3AP1在ARID1A突變患者中顯著上調(圖2g,h)。此外,預后分析顯示CD14是DGC中的不良預后蛋白質(圖2i)。這些結果表明,患有ARID1A突變的患者具有不良預后,并且激活了CD14介導的TLR信號通路。而在IGC中的結果則相反。這些結果表明,ARID1A的突變在DGC和IGC之間產生了相反的預后效應,通過對它們相應蛋白質組的多樣影響。因此,基于多層次蛋白質組學數據比較DGC和IGC是很重要的。
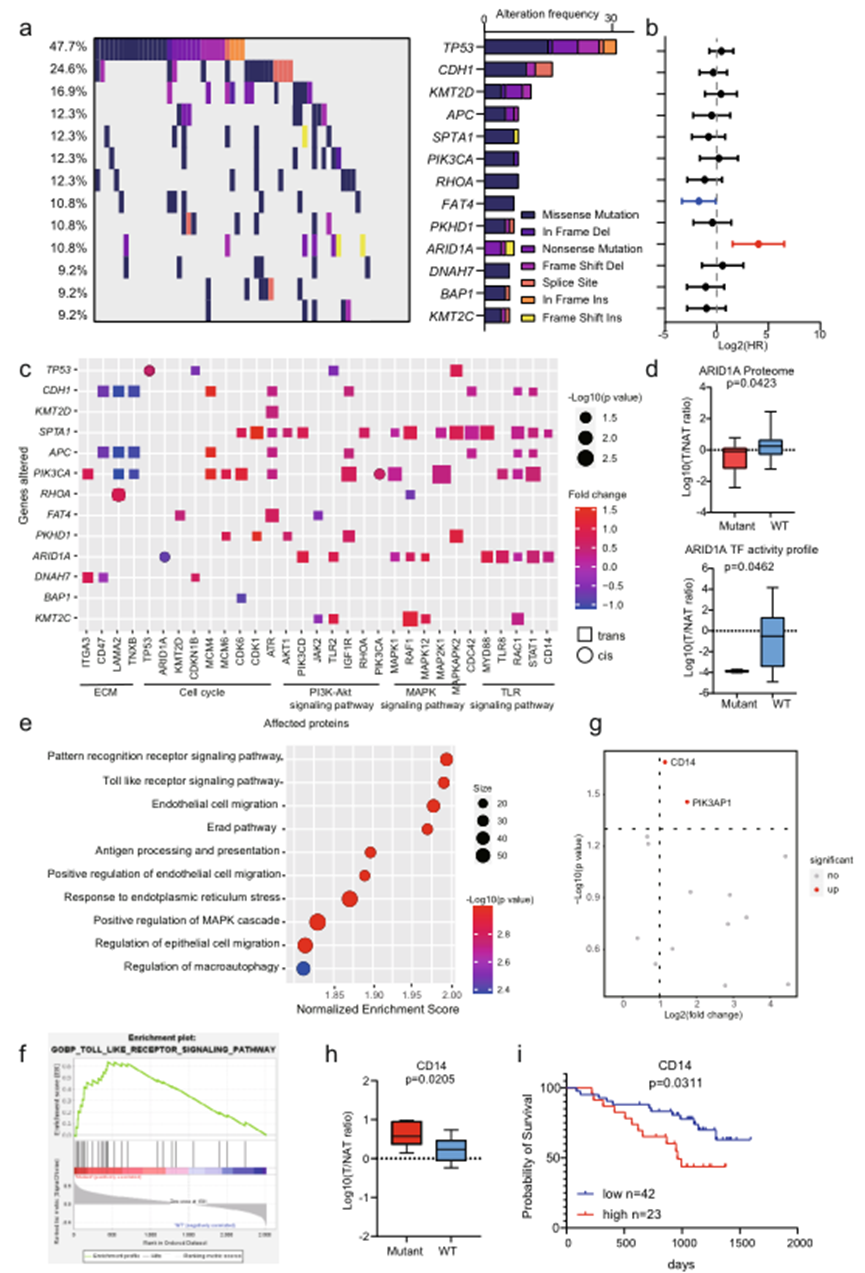
圖2 DGC蛋白基因組學分析總覽
3、綜合多層次蛋白質組學研究DGC和IGC
Lauren分類包括DGC、IGC和MGC,其中前兩種病理類型是主要的。在本研究的隊列中,臨床信息顯示DGC的發展與年齡、腫瘤位置和淋巴血管侵襲顯著相關(圖3a)。與當前的臨床知識一致,生存分析顯示IGC患者的生存時間顯著延長(圖3b)。為了進一步研究DGC和IGC之間的腫瘤異質性,比較了多層次(蛋白質組、磷酸蛋白質組和轉錄因子活性)的差異表達。根據腫瘤組織與正常對照組的比值,發現DGC和IGC之間存在384個差異表達的蛋白質。其中,83個在DGC中上調,301個在IGC中上調(圖3c)。
為了探索DGC中腫瘤微環境的不同效應,比較了DGC和IGC的xCell scores。DGC的微環境和免疫分數高于IGC(圖3d),表明DGC中免疫細胞的浸潤程度較IGC更高。隨后,比較了在DGC和IGC腫瘤中普遍存在的免疫細胞,發現DGC腫瘤中CD4+ T細胞、CD8+ T細胞和巨噬細胞的浸潤程度高于IGC腫瘤(圖3e)。對于DGC患者,觀察到RB1的磷酸化增加,TF活性降低,而E2F活性和CDK4/6水平在DGC中上調(圖3f)。這種綜合分析表明,在DGC中,RB1被磷酸化并促使與E2F的解離,增加了E2F的活性,并推動了細胞周期的進展。這些結果表明了利用CDK4/6復合物作為DGC的潛在藥物靶點的可能性。
對于IGC患者,作者通過評估激酶活性、磷酸位點和蛋白質表達水平來全面調查DNA修復網絡。包括MLH1、MSH3和MSH6在內的12個參與DNA損傷的蛋白質在IGC患者中上調(圖3g)。進一步的研究顯示,IGC患者中DNA損傷蛋白上的磷酸位點增加,包括PARP1、SMC3和SSRP1。此外,比較分析表明,IGC患者中磷酸化的ATM/ATR上調(圖3g)。先前的研究表明,ATM/ATR作為DNA修復網絡的核心組成部分,在DNA雙鏈斷裂事件中被激活以啟動同源重組修復。因此,可以推斷DNA損傷相關蛋白質可能成為IGC的潛在藥物靶點。為了進一步驗證這些發現,在TCGA隊列中驗證了DGC和IGC的潛在藥物靶點。比較了CDK4/6和ATM/ATR的表達,并發現CDK4在DGC中的表達較高,而ATR在IGC中的表達較高(圖3h)。此外,預后分析顯示CDK4和ATR的表達分別與DGC和IGC的臨床結果呈負相關(圖3i)。這些結果證明了CDK4/6和ATM/ATR分別是DGC和IGC的潛在靶點(圖3j)。
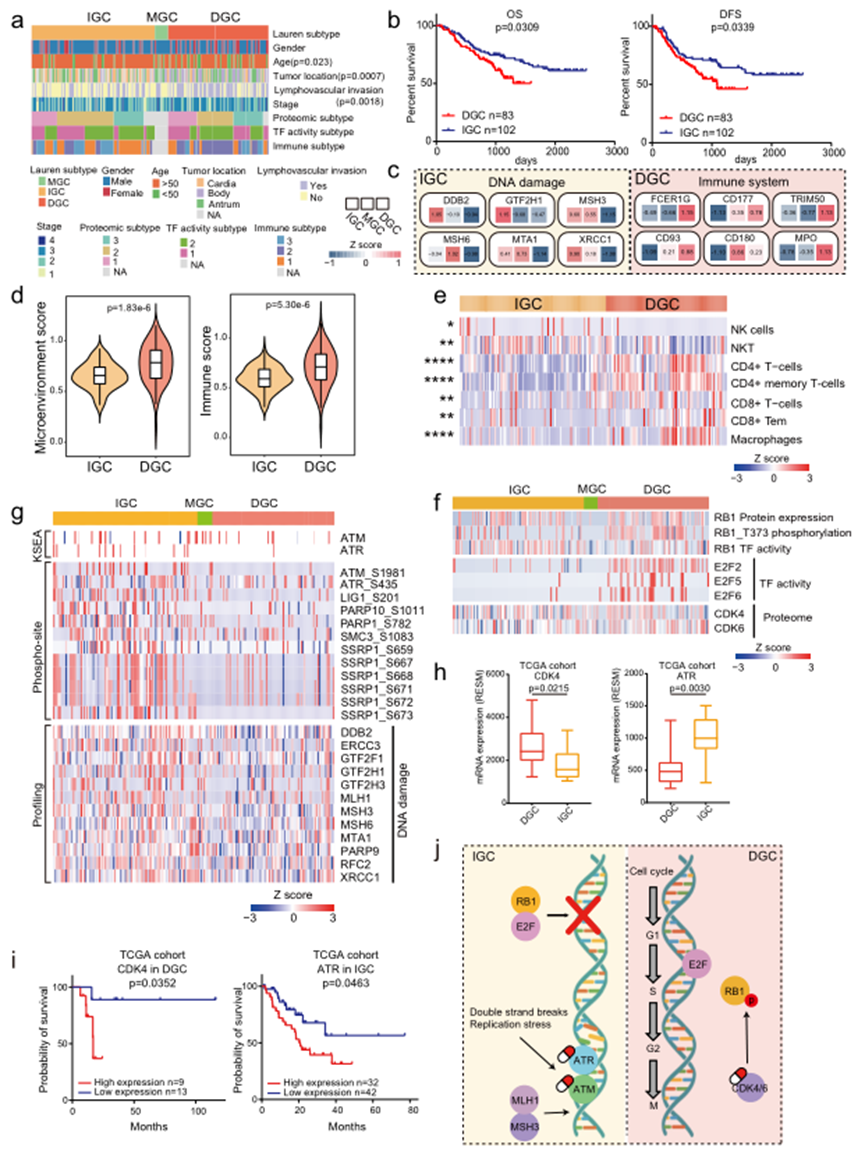
圖3 綜合多水平蛋白質組學分析顯示DGC和IGC的致病機制不同
4、胃癌的蛋白質組學亞型及其與臨床結果的關系
在臨床上,腫瘤治療在很大程度上依賴于組織學檢查。越來越多的研究表明,在每種腫瘤組織學類型中都存在不同的分子亞型,這些亞型具有不同的預后和治療靶點。基于DGC腫瘤組織與正常對照組中上調的蛋白質的共識聚類識別出三個DGC蛋白質亞型:DGC cluster 1(n = 23)、DGC cluster 2(n = 28)和DGC cluster 3(n = 28)。多變量Cox回歸分析表明,這些亞型與臨床結果顯著相關,包括性別、年齡、TNM分期和化療(圖4a,b)。這一結果表明,蛋白質亞型劃分可作為獨立的預后預測因子。
這些亞型顯示出明顯的分子特征。分別在DGC和IGC聚類中鑒定了2367和3154個差異表達蛋白質。在六個亞型中,DGC cluster 1和IGC cluster 3以細胞周期(如CDK1/2和CDK6)和DNA復制(如ORCS3和AHCTF1)為特征;DGC cluster 2和IGC cluster 2以細胞外基質組織(如DMD和MUC5AC)、膠原形成和生物合成(如CD36、COL6A1和LAMA2)為特征;許多與免疫反應相關的蛋白質(如CD163、IDO1和ICAM1),以及調節中性粒細胞脫顆粒和補體級聯的蛋白質(如FCER1G、IL 16和C5)在DGC cluster 3和IGC cluster 1中過度表達(圖4c)。
ssGSEA分析進一步表明,細胞周期和免疫應答相關的信號通路的標準化富集分數(NESs)與DGC和IGC中不同的臨床結果相關(圖4d)。調節紡錘體裝配和DNA復制中涉及的DNA解旋與DGC中的良好預后相關。然而,在IGC中,調節有絲分裂細胞周期和調節細胞周期相轉變與不良預后相關。
由于細胞周期狀態影響患者對輔助化療的敏感性,作者比較了在每個亞型中接受輔助化療和未接受輔助化療的患者的預后。發現DGC cluster 1患者對輔助化療不敏感,而IGC cluster 3患者對其敏感(圖4e)。為了評估腫瘤細胞周期相如何影響患者對化療的敏感性,進行了進一步的統計分析,發現DGC cluster 1患者中有最高比例的患者上調了S期標志性蛋白,而IGC cluster 3患者中有最高比例的患者上調了G2M期轉變標志性蛋白(圖4f)。進一步比較參與DNA復制和細胞分裂的關鍵蛋白質,發現這些蛋白質在DGC cluster 1和IGC cluster 3患者中具有相反的表達模式(圖4g)。因此,化療治療策略應在考慮腫瘤細胞的細胞周期相的基礎上制定。作者提出DNA復制過程中參與的蛋白質值得被視為DGC cluster 1的治療靶點(圖4g)。
比較DGC cluster 1和IGC cluster 3的磷酸蛋白組學揭示了亞型特異性激酶的激活,分別是CDK2和CDK1等(圖4h)。由于細胞增殖狀態和細胞周期相影響患者對化療的響應,作者嘗試基于CDK1和CDK2的表達水平來預測GC患者的化療反應。在GC隊列中,發現CDK1高表達和CDK2低表達水平的患者受益于輔助化療(圖4i),表明CDK1和CDK2水平可作為評估GC患者化療反應的生物標志物。
總的來說,蛋白質亞型在DGC和IGC中展示了蛋白質特征與預后之間的相反關聯,為臨床中患者分層和治療策略提供了指導。
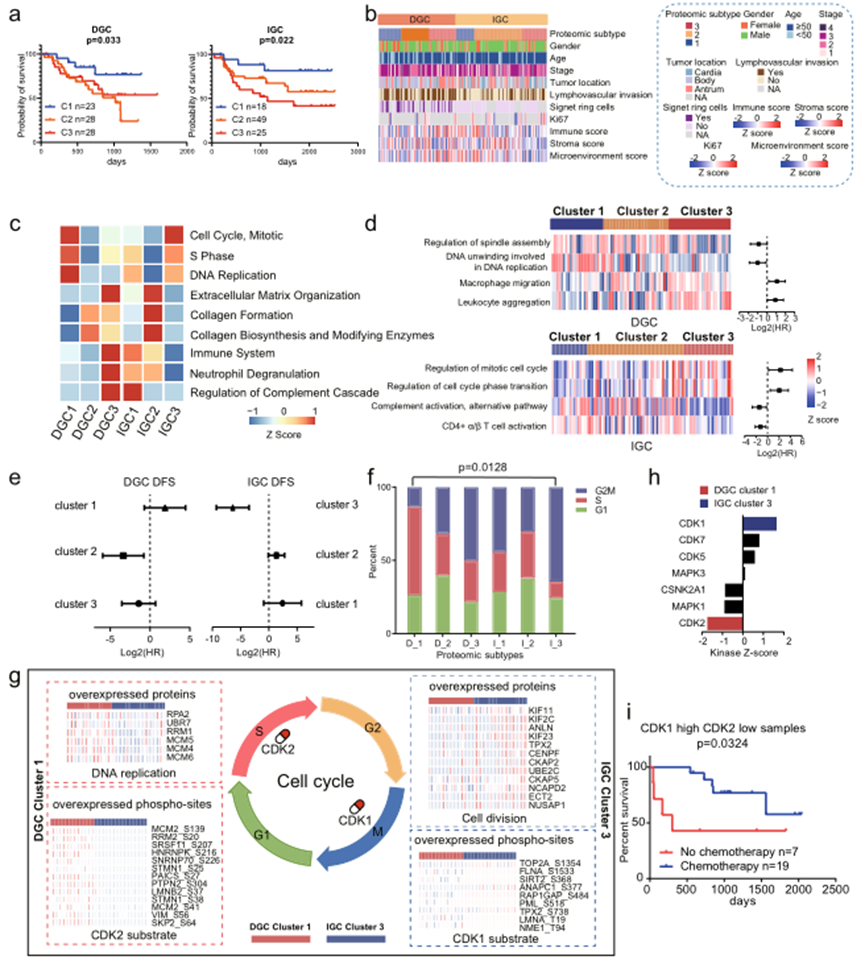
圖4 胃癌的蛋白質組學亞型及其與臨床結果的關系
5、TF活性譜及其臨床相關性
我們對DGC和IGC的425個和396個在大于50%的DGC和IGC患者中檢測到的TF進行了TF活性分析,分別在每個數據集中確定了兩個亞型。對TF活性基礎亞型的進一步分析顯示它們與患者的生存顯著相關,表明了聚類TF活性基礎亞型的預后力量(圖5a)。為了方便起見,TF活性基礎亞型被指定為DGC TF cluster 1(n = 40)、DGC TF cluster 2(n = 43)、IGC TF cluster 1(n = 42)和IGC TF cluster 2(n = 60)。對TF活性基礎亞型的臨床特征進行評估,發現與DGC TF cluster 1比較,DGC TF cluster 2包括更多具有淋巴血管浸潤的患者以及更高概率發生在胃竇(圖5b)。IGC TF cluster 2包括比IGC TF cluster 1更少的I期GC患者。
隨后,作者確定了每個TF活性基礎亞型中的主控TFs(圖5c)。在IGC TF cluster 1中主導的是NFKB2;在IGC TF cluster 2中主導的是SMARCE1和TFAP4;在DGC TF cluster 1中主導的是MLX和SMARCC1;在DGC TF cluster 2中主導的是NFKB1、RELA和IRF2。總體而言,NFKB復合物被提名為IGC TF cluster 1和DGC TF cluster 2中的主控TFs;SWI/SNF復合物被提名為IGC TF cluster 2和DGC TF cluster 1中的主控TFs。值得注意的是,對于DGC患者,DGC TF cluster 1具有更好的預后,而DGC TF cluster 2具有更差的預后;對于IGC患者,IGC TF cluster 1具有更好的預后,而IGC TF cluster 2具有更差的預后。這些結果顯示了NFKB復合物和SWI/SNF復合物在DGC和IGC中的多樣的預后相關性。
TGs的通路富集分析表明,主控TFs在不同的聚類中調節不同的生物學功能(圖5d)。例如,在IGC TF cluster 1中,NFKB復合物參與了Rho蛋白信號轉導和血小板活化,而在DGC TF cluster 2中,它參與了免疫應答、CAMs轉化和細胞遷移。另一方面,SWI/SNF復合物參與了IGC TF cluster 2中的翻譯和細胞周期進展,而在DGC TF cluster 1中參與了RNA剪接和DNA復制(圖5e–f)。
作者提出,為什么主控TFs在不同的亞型中可以調控不同的基因集。由于磷酸化是調控TF活性的基本機制,作者探討了磷酸化對主控TFs的影響,基于激酶-底物網絡。作者比較了這些TFs的磷酸化水平,發現在DGC TF cluster 2中,NFKB1的S907、S937、S939和S941的磷酸化水平增加,而在IGC TF cluster 2中,TFAP4的S124的磷酸化水平增加(圖5g)。隨后,通過相關性分析篩選可能負責這五個磷酸化位點的激酶。發現33個激酶與這五個磷酸化位點有顯著正相關(圖5h)。基于TF活性亞型的信號傳導網絡如圖5i所示。在DGC TF活性 cluster 2中,IKBKE的激酶活性與NFKB1的S941磷酸化位點呈正相關。這表明IKBKE激活了NFKB1,與先前的研究結果一致。在IGC中,ATM/ATR活性與TFAP4(磷酸化位于S124)顯著正相關,與細胞分裂相關蛋白的表達相關。正如圖3g所示,ATM/ATR在IGC中的活性高于DGC。這些觀察結果表明ATM/ATR在通過激活TFAP4等不同下游TFs調控DGC和IGC發生中的細胞分裂可能發揮潛在作用。在這里,作者根據整合的多層次蛋白質組學數據(圖5i)闡明了TF復合物在病理過程中的作用,并呈現了DGC和IGC亞型中的激酶-TF-靶基因網絡。
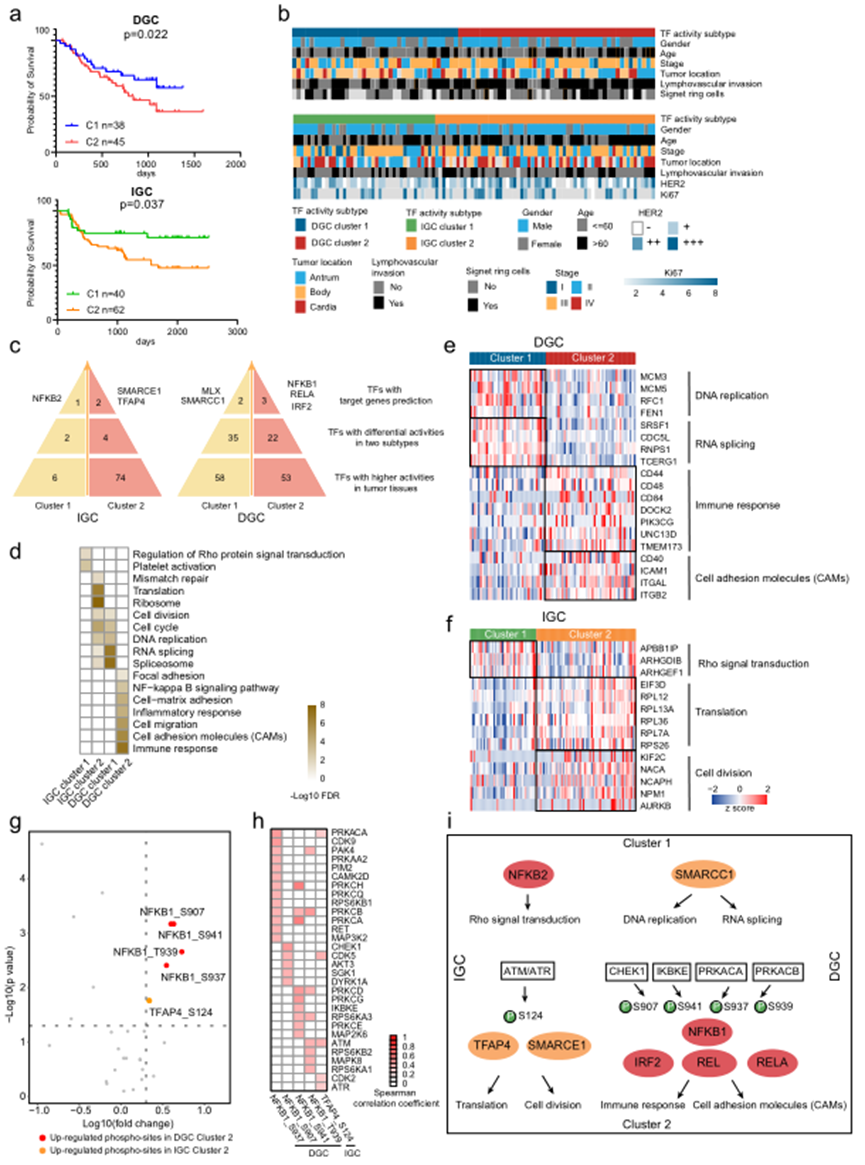
圖5 基于TF活動概況的DGC和IGC亞型
6、多水平蛋白質組亞型的特征及其穩健性
圖6a結果表明,基于TF活性的亞型、蛋白質組學的亞型和磷酸化蛋白質組學的亞型具有較高的分類一致性。此外,作者探討了TF活性亞型和蛋白質亞型之間的關聯。發現DGC蛋白質亞型cluster2的患者被分為兩個TF活性亞型(TF活性亞型cluster1中的18名患者和TF活性亞型cluster2中的10名患者(圖6b)。對于DGC蛋白質亞型cluster 2,進一步探討了兩個TF活性亞型之間的臨床和分子差異。正如預期的那樣,TF活性亞型cluster 2中的患者預后較差(圖6c),具有較高的NFKB1 TF活性和較低的SMARCC1 TF活性(圖6d)。進一步對TF活性的預后分析顯示,NFKB1 TF活性與預后呈負相關,而SMARCC1 TF活性與預后呈正相關(圖6e)。根據蛋白質組學數據比較了NFKB1和SMARCC1的TGs的表達(圖6f,g)。發現SMARCC1的靶基因,涉及RNA剪接和DNA復制, 在TF活性亞型cluster 1中上調;NFKB1的靶基因,與免疫反應有關,在TF活性亞型cluster 2中上調。總體而言,綜合亞型劃分的結果表明,蛋白質亞型與TF活性分析相結合可用于預后預測和聯合治療策略的開發。
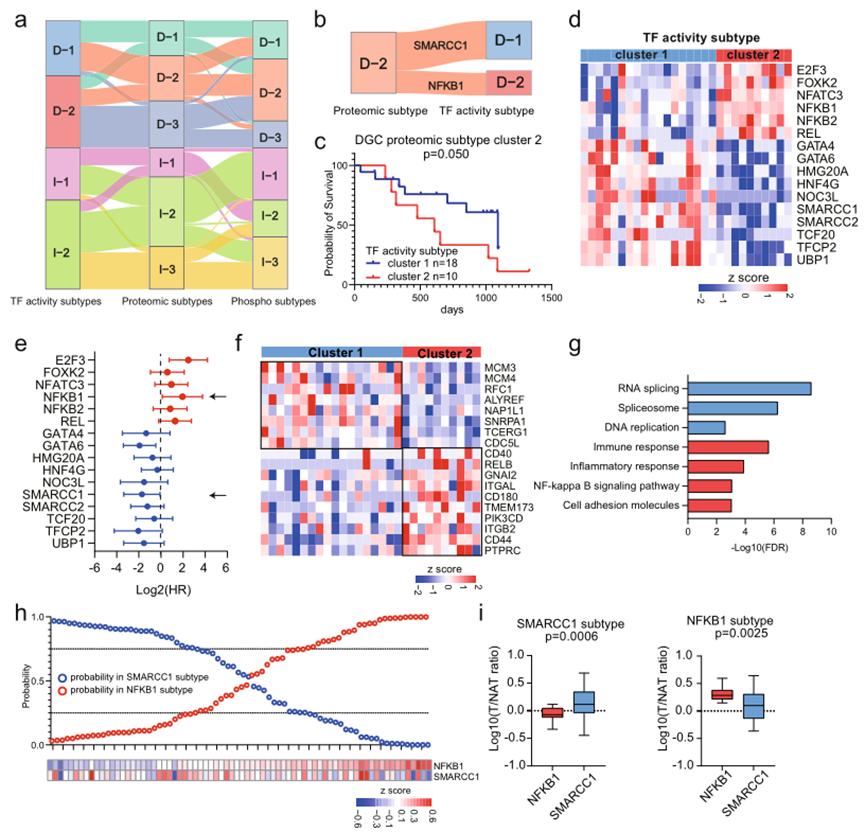
圖6 多水平蛋白質組亞型的特征及其穩健性
7、GC免疫浸潤的表征
為更好地理解GC腫瘤中免疫細胞浸潤的概念,對蛋白質組學數據進行了xCell分析,推斷了TME中多樣性細胞類型的相對豐度(Fig. 7)。基于推斷的細胞比例的共識聚類確定了以下三組具有不同免疫特征和基質特征的腫瘤集群:免疫cluster 1(n?=?69),免疫cluster 2(n?=?65),免疫cluster 3(n?=?49;Fig. 7a, b)。作者發現免疫cluster 1具有較低的免疫和基質評分,并且上皮細胞的比例較高。正如預期的那樣,ssGSEA分析表明在免疫cluster 1中上調了上皮細胞形態發生和有絲分裂細胞周期相轉變的正調節。此外,上皮細胞的經典標志物,即EPCAM,KRT18,MUC1和CDH1,在免疫cluster 1中的表達高于其他cluster(Fig. 7a)。此外,巨噬細胞的經典標志物,即TLR2和ARG148,以及免疫治療靶點,即FCGR1A,CD276和CD2720,在免疫cluster 2中的表達高于其他cluster(Fig. 7a)。至于免疫cluster 3,比其他cluster更高的基質評分,以及成纖維細胞,淋巴內皮細胞和微血管內皮細胞的比例較高。成纖維細胞增殖,ECM組裝和基于肌動蛋白絲的運動的調節在免疫cluster 3中富集。內皮細胞的經典標志物,即DCN,在免疫cluster 3中的表達高于其他cluster(Fig. 7a)。因此,免疫亞型被定義為上皮亞型(cluster 1,冷瘤),免疫亞型(cluster 2,熱瘤)和內皮亞型(cluster 3,Fig. 7b)。
多變量Cox回歸分析顯示,免疫亞型(cluster 1–3)在調整其他臨床covariates后與預后相關(Fig. 7c, d)。有趣的是,在免疫cluster 3中,DGC和IGC患者表現出相反的預后趨勢。對于IGC患者,免疫cluster 3有著最好的預后,而對于DGC患者,免疫cluster 3有著最差的預后(紅線;Fig. 7c, d)。為解決這個問題,比較了在免疫cluster 3中DGC和IGC患者的免疫細胞浸潤情況。共同淋巴祖細胞、NK細胞和Th2細胞在IGC患者中的水平高于DGC患者,而CD4+記憶T細胞、CD8+ T細胞和Th1細胞在DGC患者中的水平高于IGC患者(Fig. 7e)。DGC患者在免疫cluster 3中具有較高的Th1/Th2比率(Fig. 7f)。值得注意的是,對于所有GC患者,Th1/Th2比率與預后呈負相關(Fig. 7g),表明Th1/Th2比率可以作為GC患者的預后指標。
為驗證Th1/Th2比率與免疫治療有效性之間的關系,收集一組接受抗PD1治療的GC患者,包括7例反應迅速的病例(部分緩解,PR)和7例反應不佳的病例(疾病穩定/進展,SD/PD)。收集了來自14名治療前的GC患者的甲醛固定石蠟包埋(FFPE)腫瘤組織切片。總共測得了7705種蛋白質,平均每個樣本鑒定了4575種蛋白質。通過基于蛋白質組學輪廓的xCell分析評估了這14個樣本中的免疫細胞浸潤。如圖7h所示,計算了14個樣本的Th1/Th2比率值。發現與非應答組相比,應答組的Th1/Th2比率顯著更高(Fig. 7i)。這一結果表明,Th1/Th2比率可能是預測GC患者免疫治療臨床結果的指標(Fig. 7j)。因此,Th1/Th2比率與免疫治療有效性之間的關系在一個獨立的胃癌抗PD1治療患者群中得到了進一步驗證。
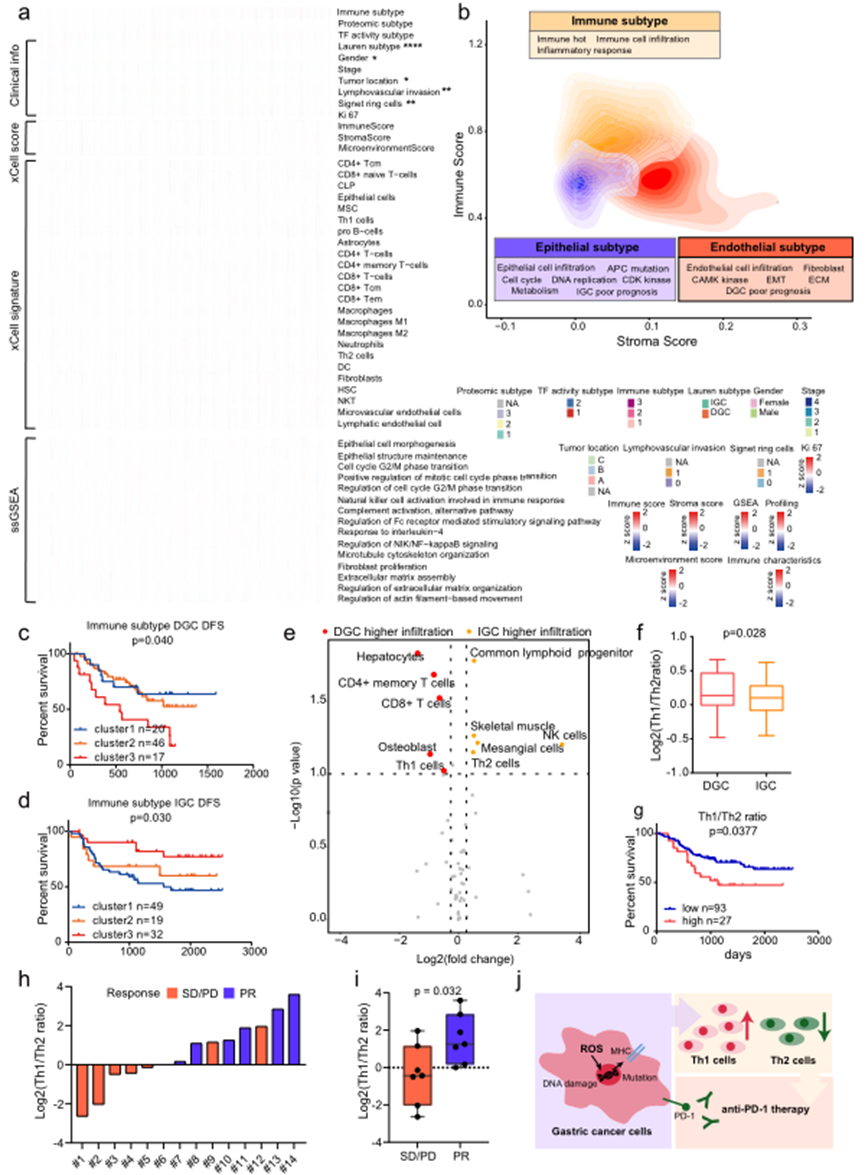
圖7 GC免疫浸潤的表征
實驗方法
臨床隊列的構建,抗PD1患者組樣本采集,細胞系的來源,靶向外顯子組測序,蛋白質提取和胰蛋白酶消化,磷酸化肽的富集,核蛋白的提取,TFRE pull-down,LC-MS/MS和數據處理,生物信息學分析
參考文獻
Shi W, Wang Y, Xu C, Li Y, Ge S, Bai B, Zhang K, Wang Y, Zheng N, Wang J, Wang S, Ji G, Li J, Nie Y, Liang W, Wu X, Cui J, Wang Y, Chen L, Zhao Q, Shen L, He F, Qin J, Ding C. Multilevel proteomic analyses reveal molecular diversity between diffuse-type and intestinal-type gastric cancer. Nat Commun. 2023 Feb 14;14(1):835. doi: 10.1038/s41467-023-35797-6. PMID: 36788224; PMCID: PMC9929250.






