腫瘤細胞來源的LC3B+細胞外囊泡通過HSP90α-IL-6/IL-8軸介導HCC腫瘤微環境與免疫治療效果之間的串擾
肝癌是全球癌癥相關死亡的第三大原因,其中肝細胞癌(hepatocellular cancer, HCC)占70%-85%。最近,ICIs治療在晚期HCC患者中顯示出有希望的療效和可控的安全性,這表明靶向腫瘤微環境是一種治療癌細胞的策略。腫瘤微環境中慢性炎癥和炎癥介質水平增加,如IL-6和IL-8,可以將免疫調節反應重定向到促癌方向。腫瘤細胞衍生的細胞外囊泡(EV)已經成為一種新的細胞間通訊模式,充當生物活性分子的載體來影響腫瘤微環境。在這項研究中,作者發現血漿IL-6和IL-8在肝癌患者中高度表達,這與總生存期短(OS)相關,并且主要由單核細胞和中性粒細胞分泌。此外,證明了LC3B+EVs上攜帶的HSP90α對于LC3B+EVs誘導的IL-6和IL-8分泌至關重要,這抑制了CD8+T細胞活性。使用體外研究的組合發現PD-1和HSP90α、IL-6或IL-8的聯合阻斷可以協同恢復CD8+T細胞功能。最后,MAP1LC3B、HSP90AA1、IL6或IL8高表達的患者抗PD-1/PD-L免疫治療效果較低。總體而言,靶向HSP90α、IL-6或IL-8與PD-1抑制劑聯合使用是HCC患者的有效新策略。
該研究于2024年2月3日發表在《Clinical Immunology》,IF:8.6。
技術路線
主要研究結果
1. 肝癌患者血漿高IL-6、IL-8與預后不良的關系
為了探討肝癌患者可能存在的免疫系統失調,采用流式熒光免疫微珠法檢測外周血中12種細胞因子(IFN-α、IFN-γ、TNF-α、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-12p70和IL-17)。發現肝癌患者中只有IL-6和IL-8顯著高于健康供者(圖1A和B)。此外,為了闡明與肝癌患者預后相關的IL-6或IL-8基因,根據Kaplan-Meier Plotter網站的數據進行了總生存期(OS)分析。結果表明,IL6,特別是IL8的高表達與較短的OS相關,并預測預后不良(圖1C)。還發現在有或沒有肝炎病毒感染或飲酒的肝癌患者中,IL8的高表達都與較短的OS相關(圖1D和E)。這些發現表明IL-6和IL-8可能參與肝癌的進展。
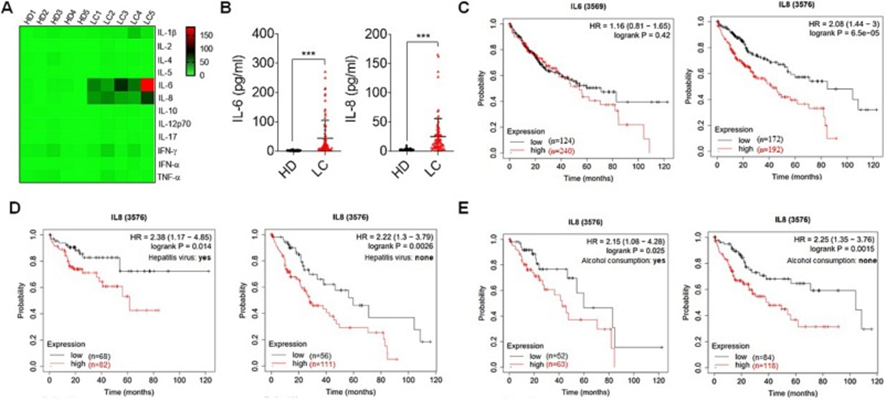
圖1:肝癌患者血漿白細胞介素-6和白細胞介素-8水平較高,與較差的生存率相關
2. 肝癌細胞來源的EVs在體外作為IL-6和IL-8分泌的關鍵調節因子
為了了解肝癌細胞分泌IL-6和IL-8的關鍵因素,在抗CD3/抗CD28存在下,將肝癌細胞與健康供體的白細胞共孵育。值得注意的是,肝癌細胞可以誘導白細胞分泌IL-6和IL-8。當通過transwell室與白細胞分離時,IL-6和IL-8的分泌也增加了(圖2A)。此外,通過在14,000 g離心30分鐘從腫瘤細胞培養基中耗盡EVs,導致白細胞產生IL-6和IL-8的顯著減少(圖2B)。這些數據表明腫瘤細胞來源的大EVs是誘導細胞因子分泌的關鍵物質之一。
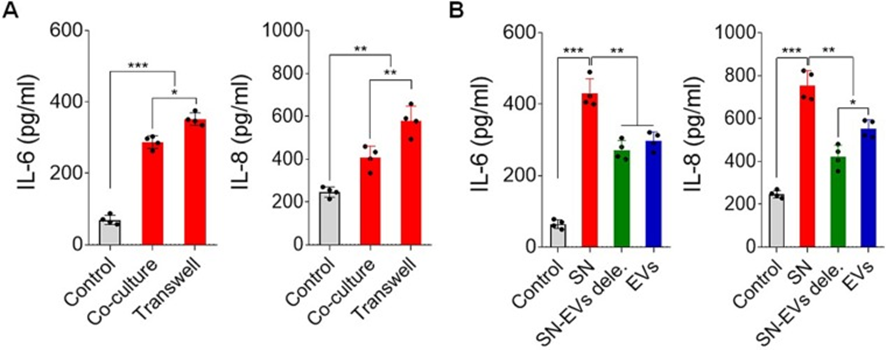
圖2:肝癌細胞來源的EVs是誘導白細胞分泌IL-6和IL-8的關鍵物質之一
3. 肝癌患者血漿LC3B+EVs與IL-6、IL-8的相關性
之前的觀察突出表明,攜帶HSP90α的LC3B+EVs是能夠促進CD4+T細胞促進腫瘤生長和轉移的優勢EVs。與作者之前的研究一致,肝癌患者血漿中LC3B+EVs和HSP90α+LC3B+EVs的比例明顯高于健康供體(HD)組(圖3A、B、C和D)。正如預期的那樣,相關分析結果顯示,LC3B+EVs,特別是HSP90α+LC3B+EVs的水平與IL-6和IL-8水平顯著正相關(圖3E)。與這一結果一致的是,基于TIMER 2.0的LC3B蛋白編碼基因MAP1LC3B和HSP90α蛋白編碼基因HSP90AA1與IL6和IL8呈正相關(圖3F和G)。此外,GEPIA2數據庫還顯示肝癌患者MAP1LC3B和HSP90AA1表達較高,預后較差(圖3H和I)。綜上所述,這些結果表明腫瘤來源的LC3B+EVs可能是誘導IL-6和IL-8分泌的關鍵物質。
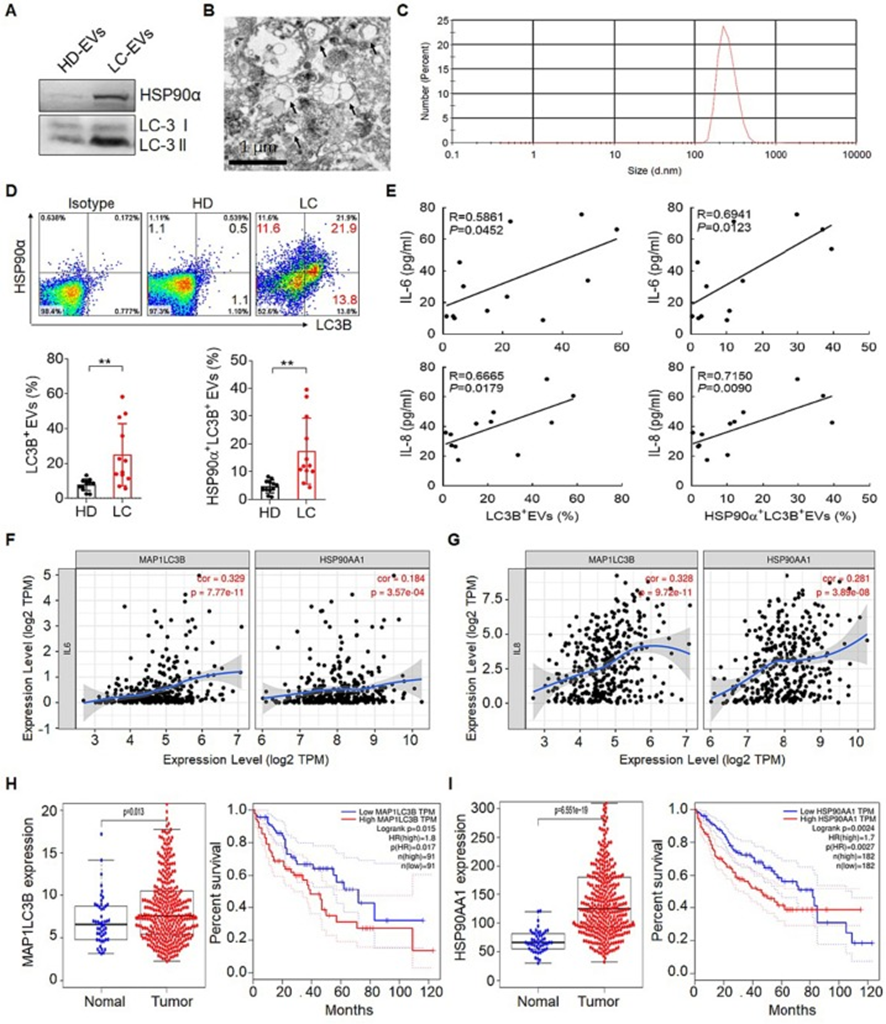
圖3:肝癌患者血漿LC3B+EVs水平較高,與預后不良相關
4. LC3B+EVs通過HSP90α促進白細胞來源的IL-6和IL-8分泌
為了確定LC3B+EVs是否影響體外IL-6和IL-8分泌,首先從人肝癌細胞的培養上清液中分離并鑒定了LC3B+EVs。HSP90α和自噬體標記LC3-I/II在LC3B+EVs中高度豐富,而CD63和CD9也存在,但水平要低得多(圖4A、B和C)。與自噬體的特征相似,LC3B+EVs被發現具有直徑為200至600 nm的雙膜結構(圖4D和E)。在抗CD3和抗CD28激活期間用LC3B+EVs處理人類白細胞后,發現LC3B+EVs在上調IL-6和IL-8分泌方面比LC3B?EVs更有效,這表明LC3B+EVs是指導白細胞的主導EVs(圖4F)。
為了確定LC3B+EVs上存在的HSP90α在誘導白細胞分泌IL-6和IL-8中的作用,用HSP90α抗體阻斷LC3B+EVs表面的HSP90α減弱了LC3B+EVs誘導的IL-6和IL-8分泌,表明膜結合的HSP90α在LC3B+EVs上起著重要作用(圖4G)。此外,用HSP90α抗體預處理的腫瘤細胞培養上清液(SN)或超速離心耗盡EVs進一步證實了上述結果(圖4H)。為了進一步證實HSP90α對LC3B+EVs的特異性作用,用HSP90αsiRNA轉染腫瘤細胞。轉染后,發現HSP90α在細胞和純化的LC3B+EVs中的表達都明顯降低(圖4I)。ELISA檢測顯示,與轉染非靶向對照siRNA的細胞的LC3B+EVs相比,轉染HSP90α-siRNA的細胞的LC3B+EVs誘導白細胞產生IL-6和IL-8的能力降低(圖4J)。這些結果表明,攜帶HSP90α的LC3B+EV是誘導IL-6和IL-8分泌的關鍵生物活性分子。
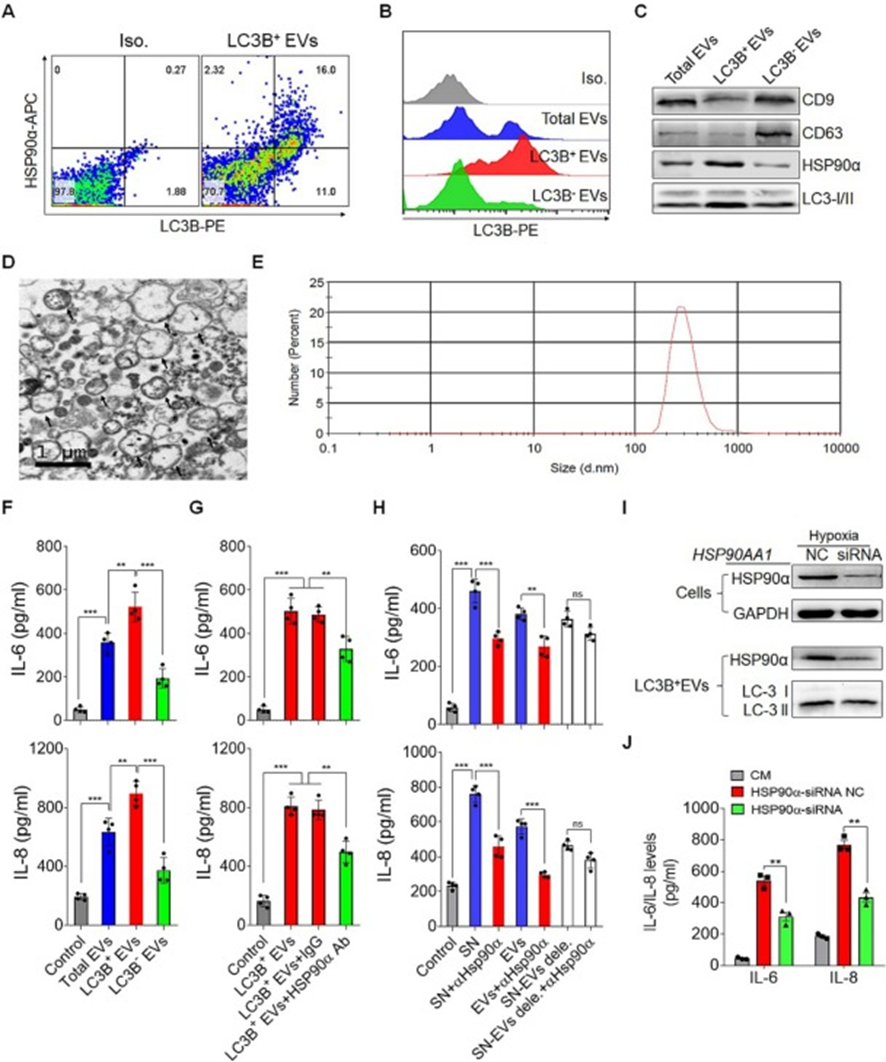
圖4:LC3B+EVs上的HSP90α對白細胞中IL-6和IL-8的誘導至關重要
5. IL-6和IL-8主要由單核細胞和中性粒細胞分泌
IL-6和IL-8可由許多細胞產生,但主要來源仍不清楚。肝癌患者流式細胞術分析顯示,肝癌患者的IL-6和IL-8產生自CD4+T細胞、CD8+T細胞、B細胞、CD14+單核細胞和中性粒細胞的比例較高,尤其是CD14+單核細胞(圖5A和B)。此外,根據FACS分析結果,可以發現IL-6和IL-8主要由CD14+單核細胞和中性粒細胞分泌(圖5C和D)。上述結果提示IL-6和IL-8主要來自肝癌患者外周血中的單核細胞和中性粒細胞。
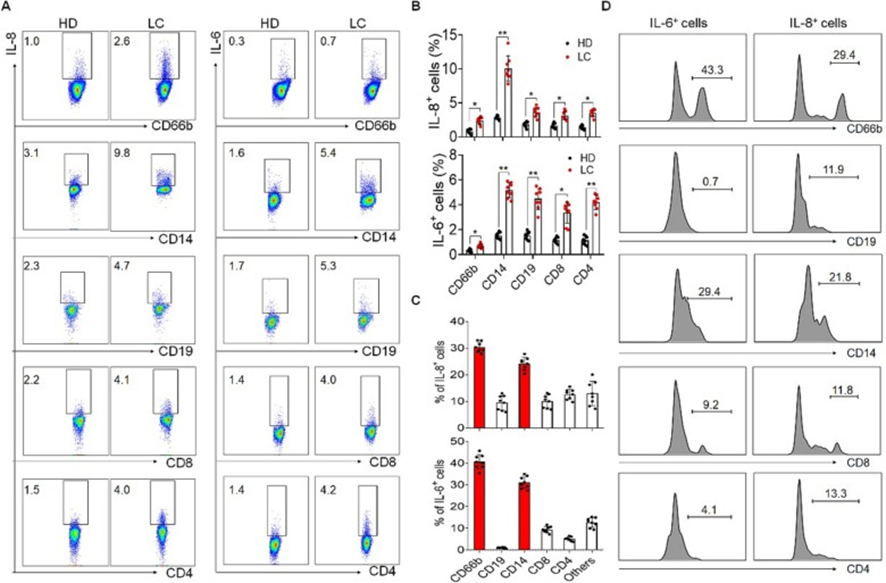
圖5:IL-6和IL-8主要由肝癌中的單核細胞和中性粒細胞分泌
6. IL-6和IL-8有助于免疫抑制微環境
為了評估IL-6 / IL-8與炎癥反應之間的關系,檢查了血漿IL-6 / IL-8水平與選定的循環免疫細胞群體之間的關聯。循環IL-6 / IL-8水平與血液中性粒細胞、單核細胞、單核細胞-淋巴細胞比值(MLR)、中性粒細胞-淋巴細胞比值(NLR)正相關,與淋巴細胞計數數量負相關(圖6A)。此外還發現高表達IL-6 / IL-8肝癌患者中CD-L1、CD14+單核細胞上CD163和CD8+T細胞上PD-1的表達顯著增加(圖6B)。與此現象一致的是,在TIMER 2.0數據庫中發現IL-6 、 IL-8水平與巨噬細胞、中性粒細胞浸潤水平或PDCD1、CD274、CD163表達水平之間存在顯著相關性(圖6C)。此外,與上述發現一致,TIMER 2.0數據庫還顯示,MAP1LC3B、HSP90AA1 mRNA水平高的肝癌患者顯示出高的巨噬細胞和中性粒細胞浸潤水平,或PDCD1、CD274、CD163表達水平(圖6D)。這些發現表明,高水平的IL-6和IL-8有助于肝癌患者的免疫抑制微環境。
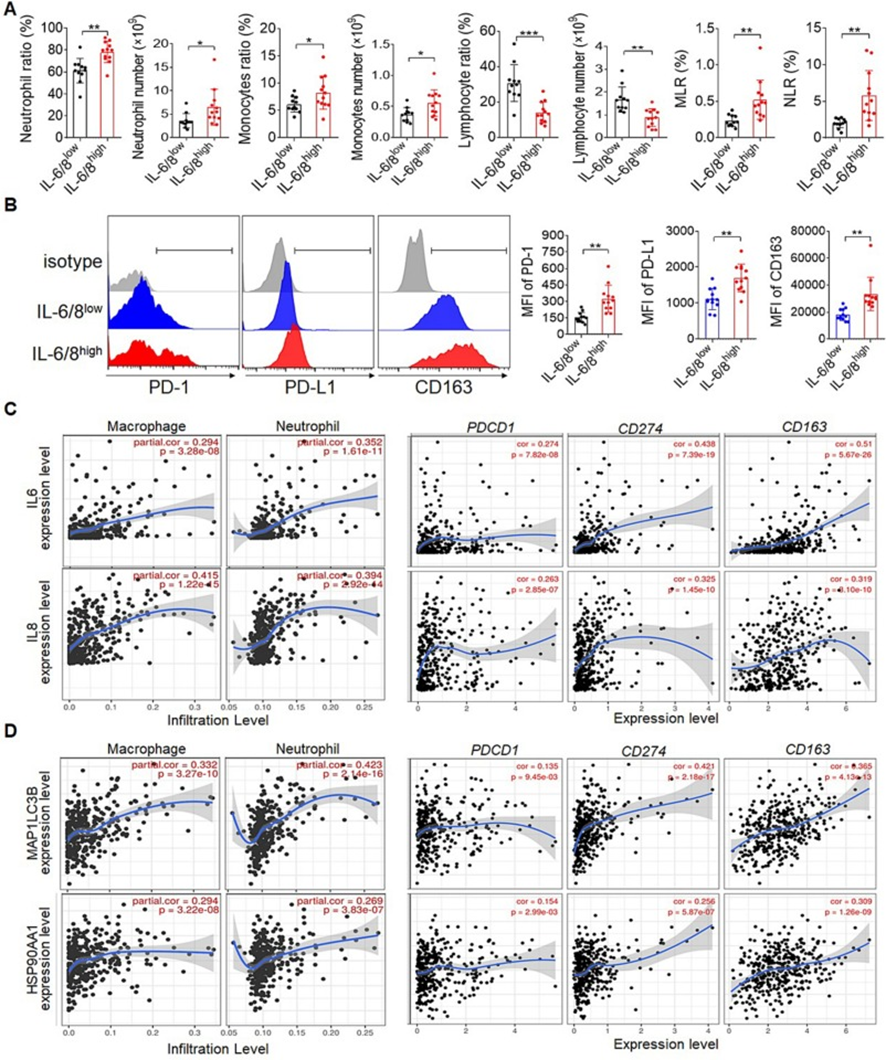
圖6:白細胞介素-6和白細胞介素-8與免疫抑制微環境顯著相關
7. LC3B+EVs通過HSP90α-IL-6/IL-8軸促進免疫抑制功能
為了進一步確保LC3B+EVs誘導的IL-6和IL-8分泌有助于免疫抑制功能,在體外用LC3B+EVs聯合HSP90α、IL-6和IL-8阻斷抗體處理白細胞,并通過FACS分析。正如預期的那樣,LC3B+EVs處理后,總CD8+T細胞中IFN-γ+CD8+T細胞的百分比降低,而阻斷HSP90α、IL-6或IL-8顯著逆轉了LC3B+EVs阻斷CD8+T細胞產生IFN-γ的情況(圖7A和B)。進一步發現培養上清液中IFN-γ和TNF-α的水平升高(圖7C)。綜上所述,這些數據表明LC3B+EVs誘導的白細胞分泌的細胞因子,包括IL-6和IL-8,參與了適應性免疫抑制功能。
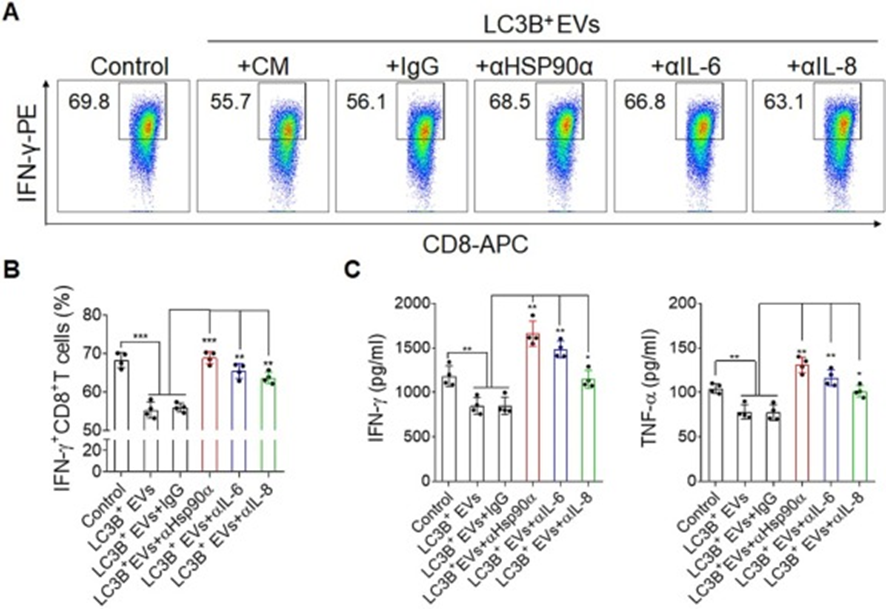
圖7:LC3B+EVs通過HSP90α-IL-6/IL-8軸促進免疫抑制功能
8. 聯合阻斷PD-1和HSP90α、IL-6、IL-8可恢復T細胞功能
作者評估阻斷HSP90α、IL-6或IL-8是否能增強PD-1誘導的T細胞活力。為此,分離了健康供者的白細胞,并在抗CD3/CD28存在下用LC3B+EVs處理,這抑制了CD8+T細胞的細胞因子分泌功能(圖8A和B)。令人驚訝的是,抗PD-1阻斷抗體增加了IFN-γ+CD8+T細胞的比例,而與HSP90α、IL-6或IL-8阻斷抗體聯合處理進一步增強了這一比例(圖8A和B)。此外,抗PD-1阻斷抗體也增加了培養上清液中IFN-γ和TNF-α的分泌,并通過聯合處理進一步增強了這一比例(圖8C)。值得注意的是,與PD-1、IL-6和IL-8阻斷抗體聯合處理并沒有進一步協同增強CD8+T細胞的功能。這些結果表明,靶向HSP90α的LC3B+EVs、IL-6或IL-8可以與抗PD-1單克隆抗體協同增強CD8+T細胞的功能,這可能為臨床治療肝癌提供一種新的方式。
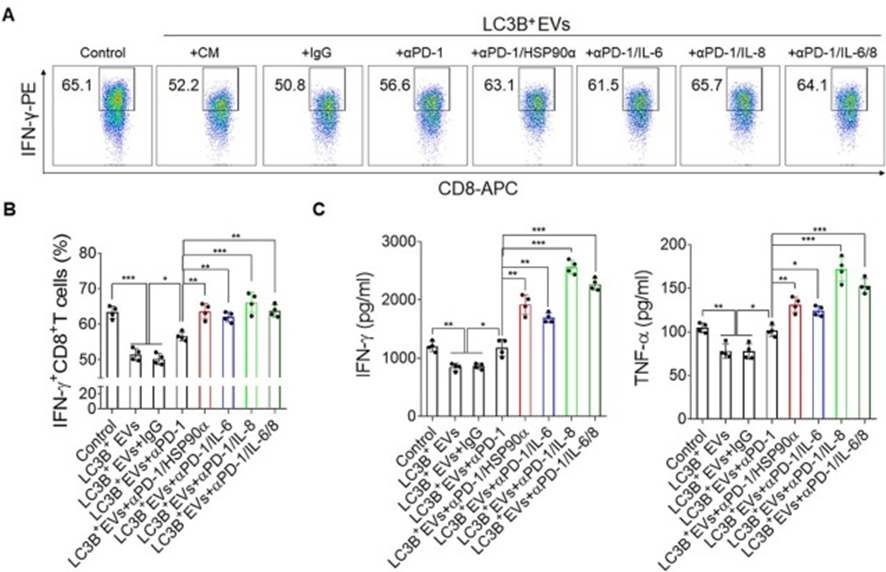
圖8:聯合阻斷PD-1和HSP90α、IL-6或IL-8增強CD8+T細胞功能
9. LC3B+EVs-HSP90α-IL-6/IL-8軸預測免疫治療療效
為了進一步探討LC3B+EVs-HSP90α-IL-6/IL-8信號軸與免疫治療之間的關系,首先分析了來自癌癥基因組圖譜(TCGA)數據集的選定腫瘤隊列中的腫瘤突變負擔(TMB),這是與免疫檢查點抑制劑(ICIs)療效相關的潛在因素,并發現MAP1LC3B、HSP90AA1、IL6或IL8轉錄本表達水平與TMB之間的低相關性(圖9A)。這些結果表明LC3B+EVs-HSP90α-IL-6/IL-8軸介導的免疫治療效果與TMB無關。隨后,來自TCGA數據集的患者根據IPS分為低免疫反應組和高免疫反應組。Kaplan-Meier生存曲線顯示,高免疫反應組中使用PD-1/PD-L1抑制劑治療的肝癌患者的整體生存率(OS)(圖9B)和PFS(圖9C)與低免疫反應組患者相比。在高免疫反應隊列中,高MAP1LC3B和HSP90AA1表達水平均與PD-1/PD-L1抑制劑治療的肝癌患者OS預后較差相關(圖9D)。同時,盡管沒有顯著差異,但IL6或IL8低的患者比IL6或IL8高的患者預后相對更好(圖9D)。然而,低免疫反應組HSP90AA1或IL8高表達的患者OS明顯比IL6或IL8低的患者差(圖9E)。這些結果表明,LC3B+EVs-HSP90α-IL-6/IL-8軸對PD-1/PD-L1抑制劑治療的肝癌患者預后較差。
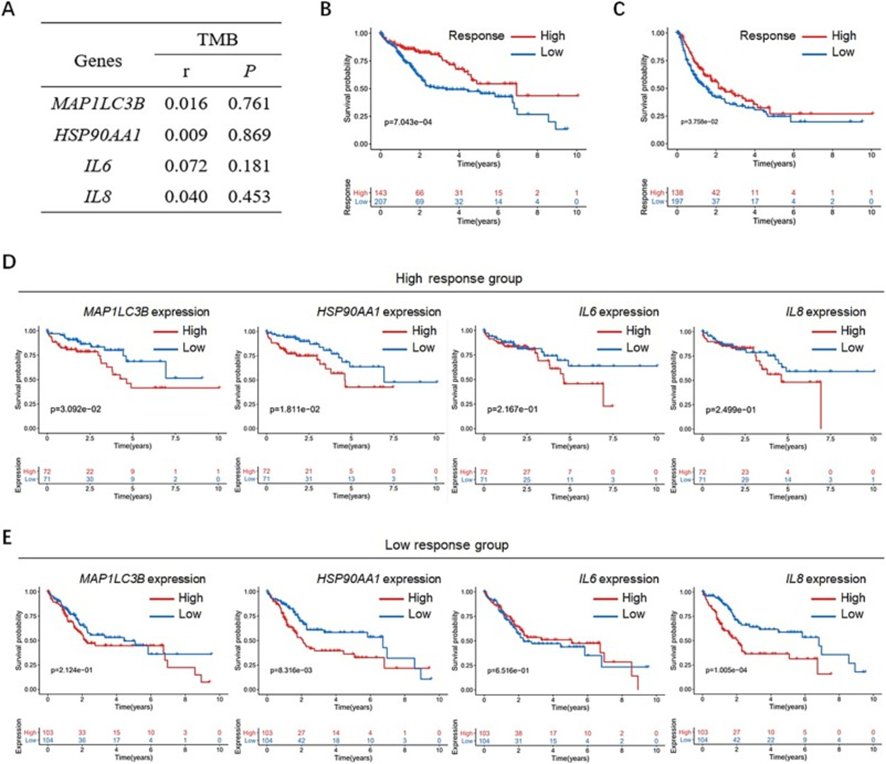
圖9:PD-1/PD-L1抑制劑治療肝臟患者MAP1LC3B、HSP90AA1、IL6、IL8水平與TMB、免疫治療效果的關系
結論
作者發現攜帶HSP90α-IL-6/IL-8軸的LC3B+EVs在驅動肝癌患者CD8+T細胞功能障礙中的基本作用。阻斷LC3B+EVs-HSP90α-IL-6/IL-8信號軸可與PD-1/PD-L1抑制劑協同恢復CD8+T細胞功能。基于復雜的腫瘤免疫微環境和發現,未來的臨床評估側重于抑制多個靶點,包括靶向LC3B+EVs上的HSP90α、IL-6或IL-8,聯合ICI可能會改善肝癌患者的預后。
參考文獻
Astier Clémence, Ngo Carine, Colmet-Daage Léo, Marty Virginie, Bawa Olivia, Nicotra Claudio, Ngo-Camus Maud, Italiano Antoine, Massard Christophe, Scoazec Jean-Yves, Smolenschi Cristina, Ducreux Michel, Hollebecque Antoine, Postel-Vinay Sophie. (2024). Molecular profiling of biliary tract cancers reveals distinct genomic landscapes between circulating and tissue tumor DNA. Exp Hematol Oncol, 13(1), 2. doi:10.1186/s40164-023-00470-7.






