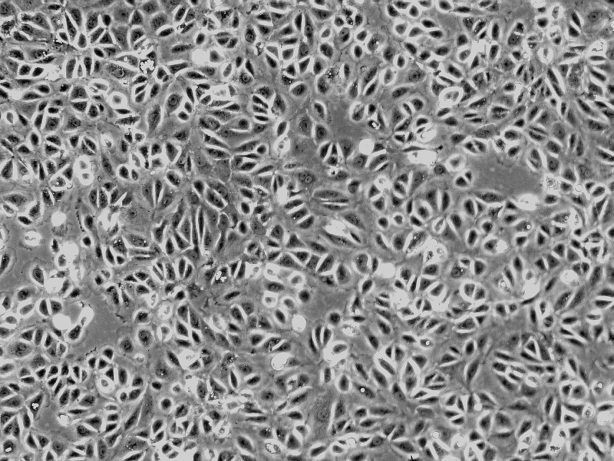
大鼠腎小管上皮細胞 RRTEpiC
大鼠腎小管上皮細胞是從人出生2天大鼠的腎中分離得到的,一代凍存,冰凍運輸。每管細胞密度超過5×10^5/ml。該細胞可通過細胞因子-18、-19和波形蛋白特異性抗體的免疫熒光進行鑒定。本細胞經檢測不含支原體、細菌、酵母菌和真菌。如采用ScienCell實驗室特制的培養基,可保證此細胞繼續增殖。然而,由于該細胞傳代后可限制膨脹能力與衰老,故不建議將此細胞繼續培養。
取材:1.腎小管節段的分離(機械網篩濾過法):
①取 Wistar 大鼠斷頸法處死,立即置入碘伏液中浸泡 5 分鐘。
②將大鼠轉移入超凈工作臺,取腰部切口迅速取出腎臟,置于盛有生理鹽水的培養皿中清洗并除去包膜和腎蒂組織。
③取皮質置于80目篩網上,剪碎成1-2mm3大小組織塊,網下放盛有少量生理鹽水的培養皿。
④用玻璃注射器內芯于80目網上充分研磨組織。
⑤收集 80 目網下液體轉移至 100 網篩上,用生理鹽水沖洗。
⑥將100目網上組織用生理鹽水沖洗入另一培養皿中,收集置入離心管中。1500 轉/分鐘離心5分鐘,棄去上清。
2 腎小管節段的消化及培養
①用1.5ml 0.25%胰蛋白酶重懸沉淀,37℃溫箱中消化約10分鐘。
②加入3ml(雙倍量)含有10%胎牛血清RPMI1640中止消化,1500 轉/分離心8分鐘,棄上清。
③加入約3ml RPMI1640 懸浮沉淀,并用吸管充分吹打混勻,接種于培養瓶中。
④分離腎小管節段接種于培養瓶后,第一天加入少量培養基,置入37℃,5%CO2孵育箱中靜置培養。
⑤培養過夜后,第二天加入足量的培養基,靜置培養。
⑥培養 72 小時后首次換液,以后每兩天換液一次。
⑦約第六到七天細胞生長基本融合成單層。
上一個:
大鼠肺成纖維細胞 RPF
下一個:
大鼠腎系膜細胞 RRMC