m6A調控的lncRNA LCAT3在肺癌中發揮致癌作用

lncRNA是重要的表觀遺傳調控因子,在多種生理和病理過程中發揮著重要作用。然而,lncRNA在肺癌發生中的調控機制尚不清楚。2021年7月發表于“Journal of Hematology & Oncology”(IF=17.388)的文章“LCAT3, a novel m6A?regulated long non?coding RNA, plays an oncogenic role in lung cancer via binding with FUBP1 to activate c?MYC”介紹了一種新的致癌lncRNA-LCAT3在肺癌發生中的調控機制。我們通過分析TCGA中肺癌組織的RNA-seq數據預測并驗證了LCAT3。通過甲基化RNA免疫沉淀來評估m6A對LCAT3的修飾。LCAT3-FUBP1-MYC軸通過雙熒光素酶報告、RNA免疫沉淀和染色質免疫沉淀檢測被評估。利用RNA-seq技術鑒定了LCAT3基因敲低改變的信號通路。此外,通過體內和體外的功能喪失和功能獲得試驗,研究了LCAT3的作用機制。結果表明,LCAT3在肺腺癌(LUAD)中表達上調,其過表達與LUAD患者的不良預后相關。LCAT3上調可歸因于甲基轉移酶3 (METTTL3)介導的m6A修飾,導致LCAT3穩定。生物學上,功能缺失分析顯示,在體外,LCAT3敲低顯著抑制肺癌細胞增殖、遷移和侵襲,在體內,抑制腫瘤生長和轉移。LCAT3敲低誘導細胞周期阻滯在G1期。在機制上,LCAT3將FUBP1招募到MYC的FUSE序列上從而激活MYC轉錄,促進肺癌細胞的增殖、存活、侵襲和轉移。
技術路線

結果:
1)LCAT3在肺癌中上調,與預后不良呈正相關
在本研究中,我們研究了一種新的lncRNA,命名為LCAT3。TCGA的RNA-seq數據分析表明,與相鄰正常組織相比,LCAT3在LUAD組織中顯著上調(圖1A)。我們進一步用qRT-PCR驗證了LCAT3在13對肺癌樣本和相應的非癌肺樣本中的表達。與RNA-seq數據一致,qRT-PCR結果證實LCAT3在肺癌組織中上調(圖1B)。重要的是,Kaplan-Meier生存分析顯示,LCAT3表達水平較高的LUAD患者總生存期和無病生存期均短于LCAT3表達水平較低的LUAD患者(圖1C, D)。采用CPAT和CPC2計算LCAT3蛋白編碼能力。LCAT3編碼蛋白質的潛力低于其他經典的lncRNA,如XIST和HOTAIR(圖1E, F),表明LCAT3最有可能是一種lncRNA。亞細胞定位分析顯示,LCAT3分布在細胞核和細胞質中(圖1G, H)。

2)METTTL3是肺癌中LCAT3上調的原因
m6A修飾是mRNA和lncRNA最普遍的轉錄后修飾,并調節其翻譯、穩定性等。我們的生物信息學分析顯示,核心m6A甲基轉移酶METTTL3確實在LUAD中上調(圖2A)。因此,我們使用CRISPR/Cas9系統敲除肺癌細胞中的METTTL3,western bolt證實了敲除效率(圖2B)。我們發現METTTL3的耗竭明顯降低LCAT3表達水平(圖2C, D)。此外,MeRIP-seq顯示在A549細胞中,LCAT3上m6A修飾富集,METTL3敲除后m6A水平降低(圖2E)。隨后MeRIP-qPCR證實METTL3敲除顯著降低了LCAT3 m6A修飾水平(圖2F)。最后,我們用放線菌素D處理肺癌細胞以阻斷轉錄,發現METTTL3敲低顯著降低LCTA3轉錄本的半衰期(圖2G, H)。總之,METTTL3介導的m6A似乎是LUAD中LCAT3上調的原因,可能是通過穩定其轉錄本。

3)LCAT3在體內和體外均可促進肺癌細胞增殖
為了研究LCAT3在肺癌細胞中的生物學功能,我們使用siRNA沉默了Calu1和Hop62肺癌細胞中的LCAT3,這充分降低了LCAT3的表達(圖3A)。CCK-8檢測顯示,LCAT3沉默后,細胞增殖明顯受到抑制(圖3B)。同樣,集落形成分析也顯示,與siRNA-NC相比,LCAT3敲除可顯著減少細胞集落(圖3C, D)。此外,EdU分析顯示,LCAT3敲除可顯著減少肺癌細胞中的DNA復制(圖3E, F)。為了進一步評估LCAT3在體內的致癌作用,我們用shRNA穩定敲除Calu1和Hop62細胞中的LCAT3,并通過皮下注射建立移植瘤小鼠模型(圖3G)。與shRNA NC組相比,LCAT3敲低組的腫瘤體積和腫瘤重量顯著降低(圖3H, I)。總體而言,LCAT3對體外和體內肺癌細胞的生長和生存都至關重要。

4)LCAT3對肺癌細胞遷移、侵襲和細胞周期進展的影響
我們探討了LCAT3對肺癌細胞遷移和侵襲的影響。Transwell分析顯示,LCAT3敲低抑制了Calu1和Hop62細胞的遷移和侵襲(圖4A, B)。為了探究LCAT3是否也在體內調節肺癌轉移,我們將熒光素標記的對照或LCAT3沉默的Calu1細胞靜脈注射到裸鼠體內,然后每周對裸鼠進行一次生物發光成像(BLI)。持續的BLI監測顯示,4周后注射LCAT3沉默的Calu1細胞的小鼠肺部轉移性生長顯著下降(圖4C, D)。為確定LCAT3基因敲除是否影響肺癌細胞周期,采用流式細胞術檢測LCAT3基因敲除和NC肺癌細胞。LCAT3敲低導致G1阻滯(圖4E, F)。Western blot檢測證實,一些細胞周期相關蛋白,如cyclin A2, cyclin B1和cyclin D1在LCAT3敲低后明顯下調(圖4G)。為了進一步分析LCAT3對肺癌的影響,我們對LCAT3敲除的肺癌細胞進行了RNA-seq。KEGG通路和GO富集分析顯示最顯著的KEGG通路和GO項是與細胞周期和細胞分裂相關的,這表明LCAT3沉默導致了細胞周期調控基因的顯著改變(圖4H, I)。

5)LCAT3與FUBP1發生物理作用,FUBP1在LUAD中也過表達
為了闡明LCAT3在肺癌細胞中作用的潛在分子機制,我們進行了RNA下拉試驗來鑒定LCAT3結合蛋白。從凝膠中剪切LCAT3義和反義之間的明顯波段用于質譜分析(圖5A)。FUBP1因其與LCAT3的特異性結合而被選擇進行進一步研究(圖5B)。此外,采用抗FUBP1抗體進行RIP檢測,進一步證明FUBP1與LCAT3之間的相互作用(圖5C)。與FUBP1結合的核心序列為LCAT3的208-342 nt,形成莖環結構。因此,我們使用LCAT3的208-342 nt片段進行RNA拉下分析。結果證實該莖環區(208-342 nt)確實負責LCAT3和FUBP1之間的結合(圖5D)。前人研究表明,FUBP1可以分為三個結構域,分別是抑制結構域、DNA和RNA結合結構域和轉錄結構域。因此,我們構建了flag標記的全長野生型FUBP1突變體的類型和三個缺失域突變體(圖5E)。RIP實驗顯示,LCAT3主要結合于DNA和RNA結合區域(100-447aa)(圖5F)。綜上所述,這些數據表明LCAT3與FUBP1發生物理作用,LCAT3的莖環區(208-342 nt)和FUBP1的DNA和RNA結合域(100-447aa)是LCAT3與FUBP1結合所必需的。此外,我們發現,FUBP1的mRNA和蛋白水平在LUAD中均顯著上調(圖5G, H),且在肺癌患者中,FUBP1的高表達與較短的生存時間相關(圖5I)。

6)FUBP1沉默可抑制肺癌細胞的增殖和存活
FUBP1在LUAD中的生物學功能尚未被報道,因此,我們通過siRNA敲除A549和Calu1細胞中的FUBP1來評估腫瘤細胞表型的潛在變化。在FUBP1敲低(圖6A, B)時,我們觀察到肺癌細胞的生長(圖6C)和菌落存活(圖6D)受到顯著抑制。此外,與LCAT3敲低一樣,FUBP1敲低也抑制A549和Calu1肺癌細胞的遷移(圖6E, F),并通過顯著降低cyclin A2和cyclin D1水平觸發G1阻滯(圖6H, I)(圖6G)。總的來說,FUBP1通過增強肺癌細胞的惡性表型發揮致癌作用。

7)LCAT3和FUBP1共同調控c-Myc的表達
我們假設LCAT3將與FUBP1合作調節MYC表達。結果表明,FUBP1的敲除顯著抑制了c-MYC mRNA和蛋白質的水平(圖7 A, B)。 LCAT3敲除也顯著降低c-MYC mRNA和蛋白的水平在A549和Calu1細胞(圖7C, D)。因此,與FUBP1一樣,LCAT3也是一個c-MYC陽性調節因子。有趣的是,雖然LCAT3或FUBP1的敲低降低了c-MYC的水平,但同時敲低LCAT3和FUBP1并不能進一步降低c-MYC的水平(圖7E, F),這表明LCAT3和FUBP1在同一調控點調控c-MYC的表達。

8)LCAT3招募FUBP1激活MYC轉錄
芯片分析表明,FUBP1在肺癌細胞中與c-MYC啟動子結合(圖8A)。FUBP1在LCAT3敲低后顯著降低(圖8 B, C)。因此,LCAT3似乎是FUBP1與c-MYC啟動子結合所必需的。然后,然后,我們測試了LCAT3是否通過將FUBP1招募到c-MYC啟動子上的FUSE序列中來激活c-MYC表達。使用c-MYC啟動子驅動的熒光素酶報告基因,在有或沒有FUSE序列的情況下(圖8D),我們發現LCAT3或FUBP1基因敲低后,c-MYC啟動子活性受到抑制,這種抑制方式依賴于FUSE序列(圖8E, F)。因此,LCAT3將FUBP1招募到MYC FUSE序列中來激活其轉錄。
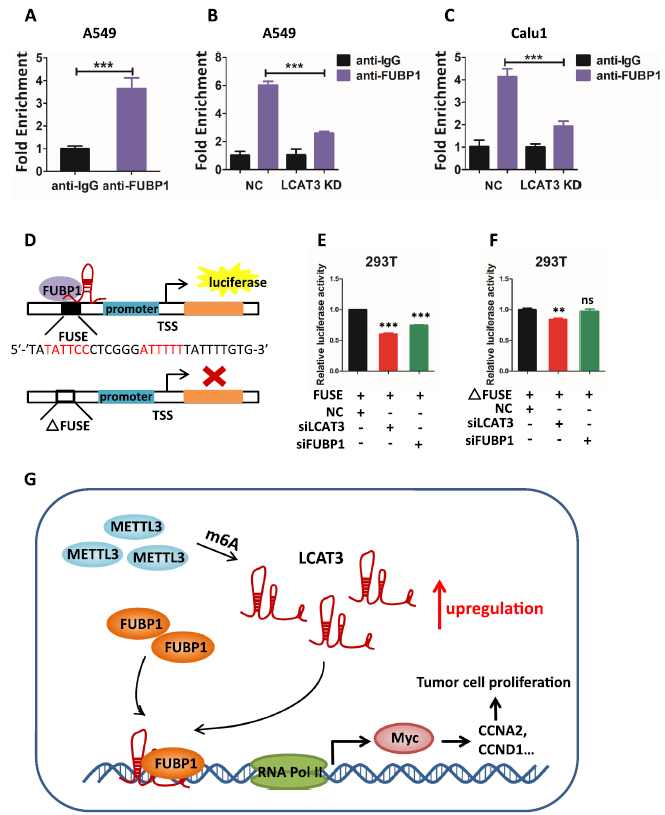
結論:我們鑒定并表征了肺癌中m6A調控的新lncRNA -LCAT3。METTTL3通過m6A修飾穩定LCAT3。過表達的LCAT3將FUBP1招募到c-MYC啟動子上,以激活c-MYC表達,導致肺癌細胞增殖、存活、遷移/侵襲和轉移增強。我們的研究揭示了LCAT3-FUBP1-cMYC軸的致癌作用,并將其描述為一個有前景的預后生物標志物和潛在的肺癌治療靶點。






