HIF-2α激活通過增加細(xì)胞內(nèi)的鐵來增強(qiáng)結(jié)腸癌細(xì)胞的氧化死亡

結(jié)腸癌(CRC)是世界上第三常見的癌癥,也是癌癥相關(guān)死亡的主要原因。癌細(xì)胞迅速擴(kuò)張,所有實(shí)體瘤由于血管化不足而經(jīng)歷缺氧。缺氧是實(shí)體腫瘤的一個(gè)標(biāo)志,它促進(jìn)細(xì)胞生長(zhǎng)、生存和轉(zhuǎn)移,并對(duì)化療和放療產(chǎn)生耐藥性。缺氧反應(yīng)主要由轉(zhuǎn)錄因子缺氧誘導(dǎo)因子1α (HIF-1α)和HIF-2α介導(dǎo),而HIF-1α和HIF-2α在CRC中表現(xiàn)出不同的作用。我們的研究表明,癌癥細(xì)胞依賴于HIF-2α的一種機(jī)制脆弱性,可用于CRC治療。該研究2021年6月發(fā)表在《JOURNAL OF CLINICAL INVESTIGATION》,IF為14.808。
技術(shù)路線:
主要研究結(jié)果:
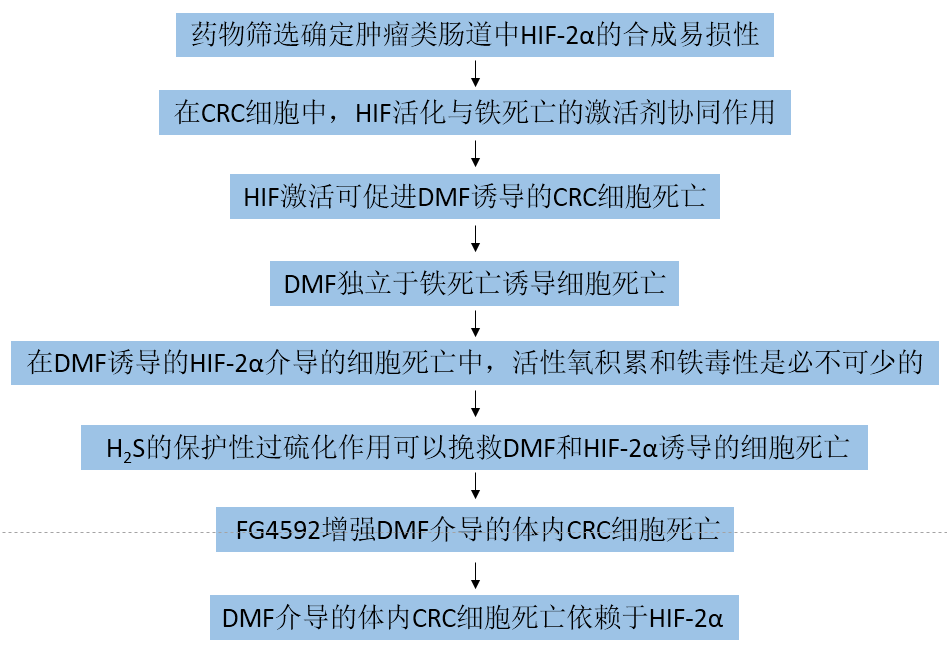
1. 藥物篩選確定腫瘤類腸道中HIF-2α的合成易損性
作者構(gòu)建Apc缺失型(Cdx2-ERT2Cre;Apcfl/fl)和CRC HIF-2α過表達(dá)小鼠模型(Cdx2-ERT2Cre;Apcfl/fl HIF-2αLSL/LSL),從這2個(gè)小鼠模型中分離腸類藥物,并用化療藥物培養(yǎng),生長(zhǎng)被監(jiān)測(cè)了5天(圖1A)。在Cdx2-ERT2Cre;在Apcfl/fl HIF-2αLSL/LSL小鼠中,他莫昔芬可誘導(dǎo)HIF-2α,并特異性地破壞結(jié)腸上皮細(xì)胞中的Apc。來自Cdx2-ERT2Cre;Apcfl/fl腫瘤腸系膜的小鼠對(duì)doxorubicin, mitoxantrone, irinotecan,以及 eribulin等藥物高度敏感,與來自Cdx2-ERT2Cre;Apcfl/fl HIF2αLSL/LSL的不同(圖1B)。RSL3、sorafenib索拉菲尼、erastin和DMF被認(rèn)為是最有效的小分子,可以顯著降低Cdx2-ERT2Cre;Apcfl/fl HIF2αLSL/LSL腫瘤腸道類物質(zhì)的生長(zhǎng)(圖1C)。Erastin和RSL3是經(jīng)典的ferroptosis激活劑,分別抑制xCT(由Slc7a11基因編碼,是xC系統(tǒng)的一個(gè)組成部分)和GPX4。DMF一種細(xì)胞可滲透的線粒體衍生物,在一些癌癥細(xì)胞系中具有細(xì)胞毒性(圖1D)這些結(jié)果表明,HIF-2α表達(dá)的腫瘤可以被氧化應(yīng)激激活劑選擇性靶向。
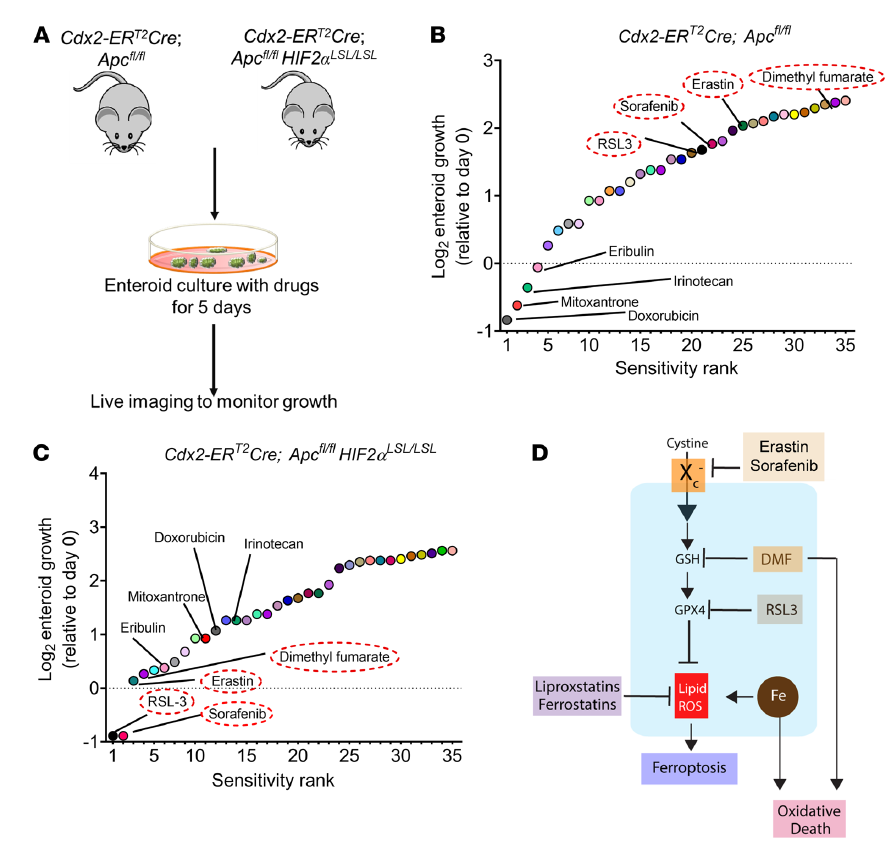
圖1 篩選能抑制過表達(dá)HIF-2α的腫瘤腸樣細(xì)胞生長(zhǎng)的化合物
2. 在CRC細(xì)胞中,HIF活化與鐵死亡的激活劑協(xié)同作用
Erastin和RSL3是經(jīng)典的鐵死亡誘導(dǎo)劑,作者已證明,缺氧模擬FG4592或缺氧顯著增強(qiáng)了鐵死亡誘導(dǎo)物erastin和RSL3以HIF-2α依賴的方式處理后的細(xì)胞死亡。作者在最后一次給藥后14天,分析這些小鼠的結(jié)腸組織的組織學(xué)變化(圖2A)。Slc7a11的缺失或HIF-2α的過度表達(dá)與對(duì)照動(dòng)物的情況無法區(qū)分(圖2B)。然而,Slc7a11的破壞與HIF-2α過表達(dá)聯(lián)合導(dǎo)致結(jié)腸上皮變性和空泡化(圖2B)。通過4-羥基2-壬烯醛(4-HNE)染色測(cè)定脂質(zhì)過氧化誘導(dǎo)的氧化應(yīng)激(圖2C)。與對(duì)照組相比,Villin-CreERT2Slc7a11fl / fl; HIF-2αLSL/LSL小鼠的組織學(xué)評(píng)分(圖2D)和4-HNE強(qiáng)度(圖2E)均顯著增加,表明這些小鼠氧化應(yīng)激和上皮細(xì)胞損失增加。此外,與對(duì)照組比較,Villin-CreERT2-HIF-2αLSL/LSL小鼠的HILPDA和PLIN2 mRNA水平顯著升高(圖2F)。與對(duì)照組相比,Villin-CreERT2-HIF-2αLSL/LSL小鼠肝臟和腸道鐵水平都更高(圖2G)。肝臟鐵含量的增加是由于小腸對(duì)鐵的吸收增加。這些數(shù)據(jù)證實(shí)了HIF-2α在體內(nèi)對(duì)鐵死亡敏感的作用,并提示誘導(dǎo)鐵死亡的藥物可能對(duì)缺氧細(xì)胞有很高的殺傷效果。
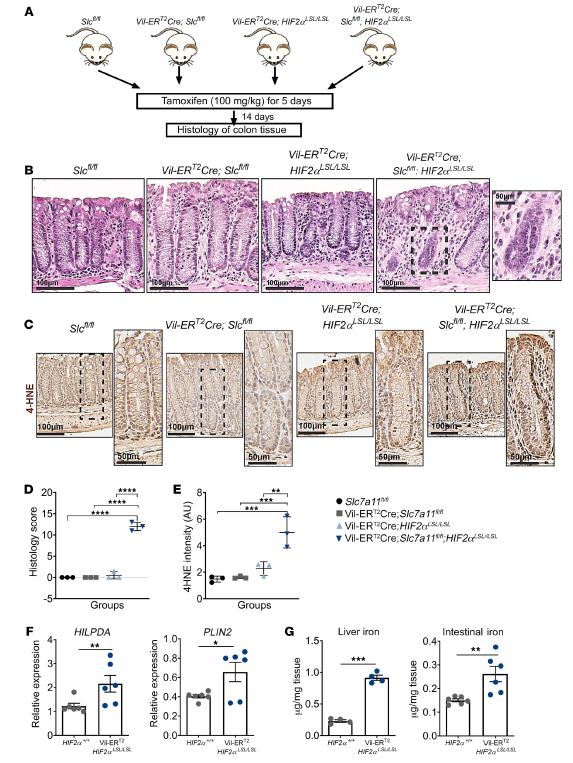
圖2. HIF-2α激活可增強(qiáng)體內(nèi)鐵死亡
3. HIF激活可促進(jìn)DMF誘導(dǎo)的CRC細(xì)胞死亡
作者的篩選鑒定出DMF是一種小分子,可以有效地減少低氧腫瘤腸道樣體的生長(zhǎng)(圖1C)。一組CRC細(xì)胞系使用DMF單獨(dú)或聯(lián)合缺氧或模擬缺氧FG4592處理。通過MTT和長(zhǎng)期克隆生存試驗(yàn)評(píng)估,FG4592增強(qiáng)DMF誘導(dǎo)的CRC細(xì)胞死亡(圖3,A- C)。此外,DMF處理和缺氧培養(yǎng)的細(xì)胞存活率較低(圖3,D和E)。與erastin和RSL3數(shù)據(jù)一致,HIF-2α是促進(jìn)DMF介導(dǎo)的CRC細(xì)胞生長(zhǎng)的關(guān)鍵(圖3F)。
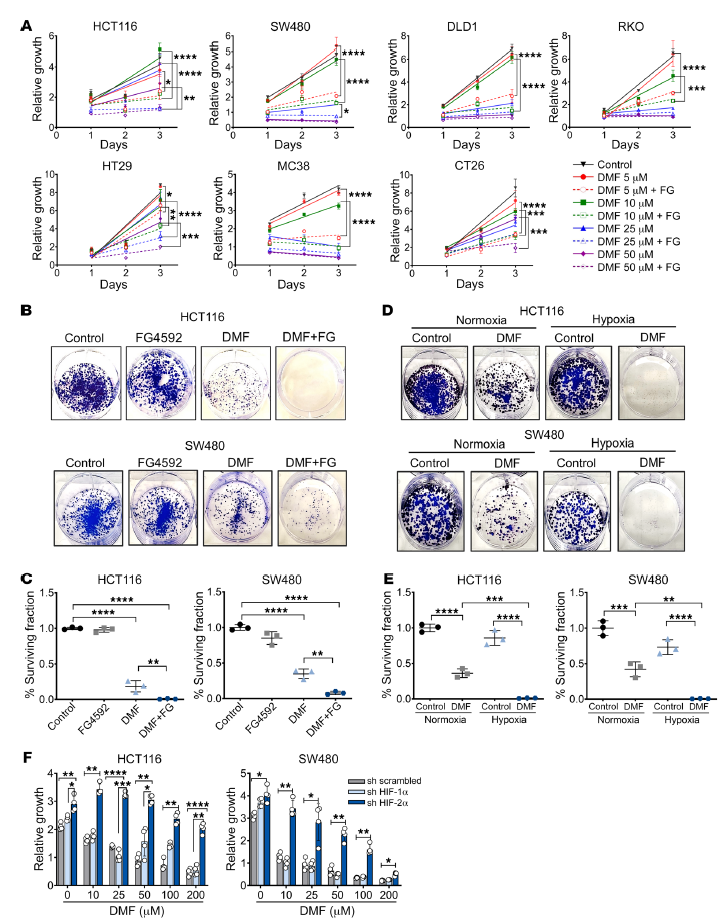
圖3. 缺氧模擬有助于DMF誘導(dǎo)的CRC細(xì)胞生長(zhǎng)抑制
4. DMF獨(dú)立于鐵死亡誘導(dǎo)細(xì)胞死亡
由于DMF與其他細(xì)胞對(duì)鐵死亡激活劑一起有效地降低了缺氧細(xì)胞的生長(zhǎng)(圖1C),我們?cè)u(píng)估了DMF是否介導(dǎo)了鐵死亡激活劑的死亡。在DMF處理后,Fer-1和Lip-1不能挽救細(xì)胞的死亡和活力,而rsl3介導(dǎo)的細(xì)胞死亡被Fer-1和Lip-1挽救(圖4A)。在DMF處理后,Fer-1和Lip-1不能挽救細(xì)胞的死亡和活力,而RSL3介導(dǎo)的細(xì)胞死亡被Fer-1和Lip-1挽救(圖4A)。DMF可與抗氧化劑GSH直接反應(yīng),導(dǎo)致NADPH降低,ROS增強(qiáng)。然而,FG4592和糖酵解抑制劑的共同作用并沒有降低細(xì)胞活力(圖4E)。這些結(jié)果表明,在DMF介導(dǎo)的缺氧腫瘤細(xì)胞死亡中有其他機(jī)制參與。
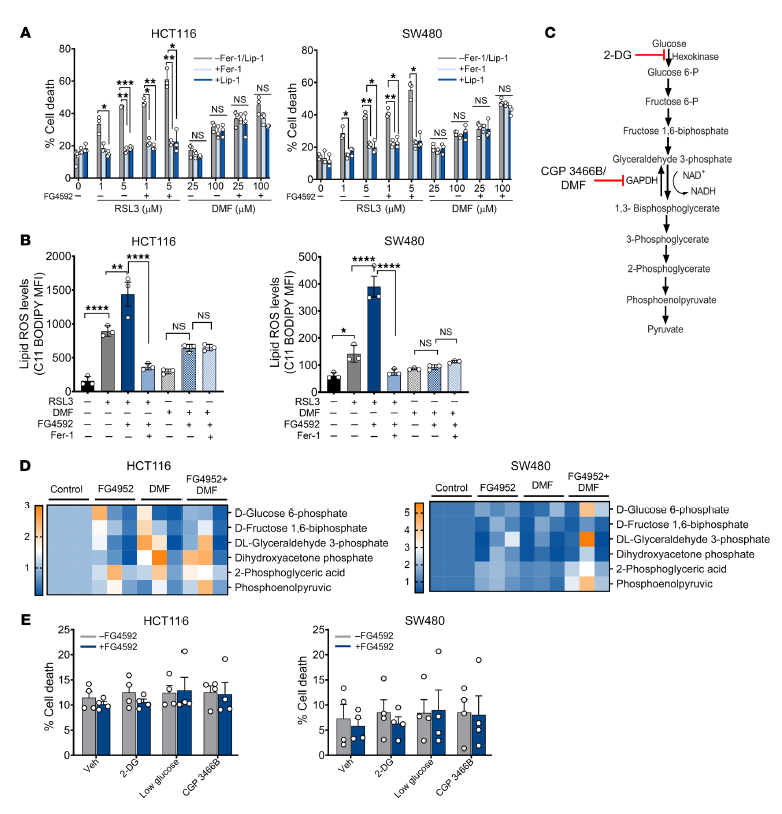
圖4. DMF在CRC細(xì)胞中不是鐵轉(zhuǎn)移誘導(dǎo)物。
5. 在DMF誘導(dǎo)的HIF-2α介導(dǎo)的細(xì)胞死亡中,活性氧積累和鐵毒性是必不可少的
添加半胱氨酸前體n -乙酰半胱氨酸(NAC)的生長(zhǎng)培養(yǎng)基挽救了含或不含FG4592 DMF處理的HCT116和SW480細(xì)胞的死亡和活力(圖5A和補(bǔ)充圖9C)。在DMF處理和維持缺氧的細(xì)胞中也觀察到類似的結(jié)果(圖5B)。FG4592或單獨(dú)的缺氧處理增加了ROS,這是通過細(xì)胞滲透的2,7 -二氯二氫熒光素二醋酸酯(H2DCFDA)評(píng)估的,它被用作ROS的指標(biāo)(圖5,C和D)。與DMF的協(xié)同處理增強(qiáng)了ROS生成的增加,而NAC可以挽救ROS生成(圖5,C和D)。為了證實(shí)對(duì)氧化細(xì)胞死亡的敏感性是由HIF-2α介導(dǎo)的,利用了shRNA介導(dǎo)的HIF-1α和HIF-2α敲低細(xì)胞。HIF-2α敲低細(xì)胞中的ROS水平顯著降低(圖5E),表明DMF處理后HIF-2α在ROS產(chǎn)生中的作用。
由于HIF激活會(huì)導(dǎo)致線粒體代謝的變化和ROS的產(chǎn)生,作者分析了DMF或FG4592處理是否會(huì)引起線粒體代謝物池的變化。然而,線粒體代謝物水平未見顯著變化,表明HIF-2α通過其他機(jī)制影響細(xì)胞ROS(圖5F)。由DMF和FG4592介導(dǎo)的細(xì)胞死亡在低鐵和對(duì)照培養(yǎng)基中被挽救(圖5G)。總之,這些數(shù)據(jù)表明,鐵毒性通過HIF-2α和氧化應(yīng)激脆弱性的機(jī)制。
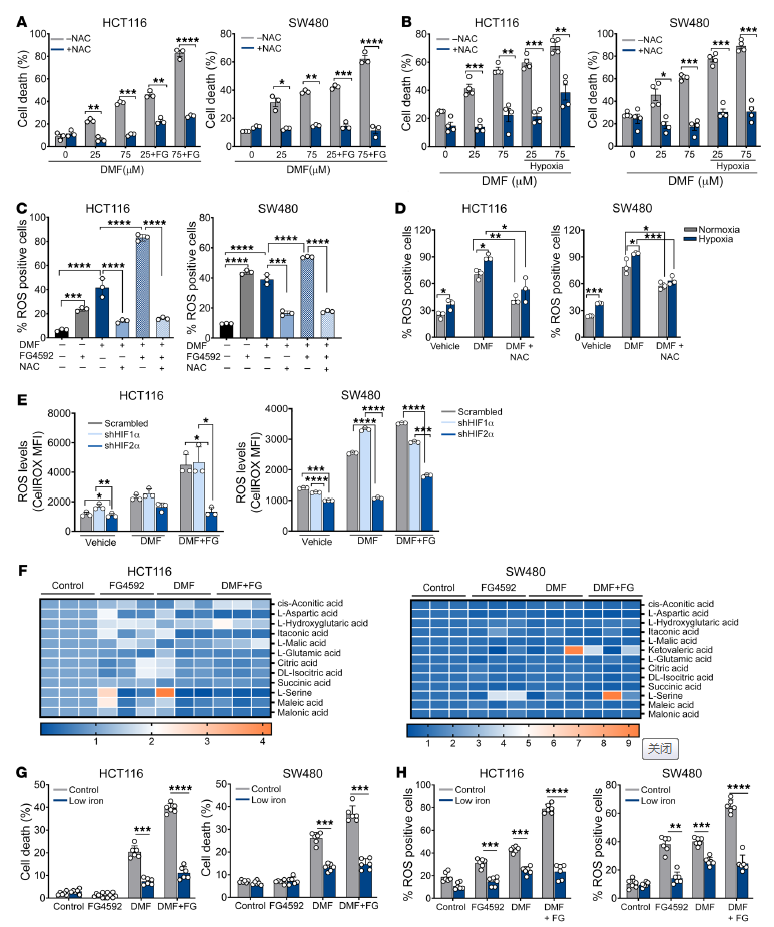
圖5. 活性氧的產(chǎn)生和鐵的積累參與DMF和FG4592介導(dǎo)的CRC細(xì)胞死亡
6. H2S的保護(hù)性過硫化作用可以挽救DMF和HIF-2α誘導(dǎo)的細(xì)胞死亡
接下來,評(píng)估了不可逆的蛋白質(zhì)氧化是否參與了DMF和FG4592誘導(dǎo)的細(xì)胞死亡。H2S可通過過硫化作用(翻譯后修飾)防止半胱氨酸硫醇的過度氧化(圖6A) 為了排除H2S的保護(hù)作用不是由于DMF上的硫化物陰離子親核添加導(dǎo)致的DMF消耗,在DMF和FG4592或DMF和缺氧導(dǎo)致細(xì)胞死亡16小時(shí)后,將Na2S和3-MP添加到新鮮培養(yǎng)基中(圖6B)。即使在這些條件下,Na2S和3-MP也能防止細(xì)胞死亡(圖6,C和D)。此外,補(bǔ)充3-MP和Na2S后,DMF或DMF和FG4592誘導(dǎo)的細(xì)胞內(nèi)ROS水平降低(圖6E)。這些數(shù)據(jù)與模型一致,即DMF增強(qiáng)HIF誘導(dǎo)的細(xì)胞死亡涉及氧化蛋白損傷,而氧化蛋白損傷受到H2S的保護(hù)。
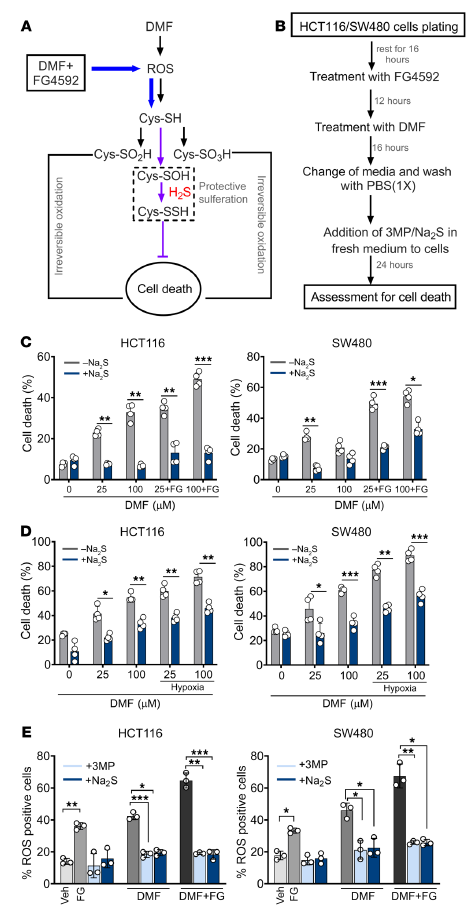
圖6. H2S可防止不可逆的蛋白質(zhì)氧化,挽救DMF和FG4592介導(dǎo)的細(xì)胞死亡
7. FG4592增強(qiáng)DMF介導(dǎo)的體內(nèi)CRC細(xì)胞死亡
接下來,作者評(píng)估了DMF和FG4592聯(lián)合治療已建立的CRC腫瘤的體內(nèi)療效。此,HCT116、SW480和DLD1細(xì)胞被皮下植入免疫缺陷小鼠的側(cè)壁,并在DMF和FG4592治療前建立10天(圖7A)。從與接受對(duì)照或單獨(dú)藥物治療的患者相比,在所有3個(gè)異種移植中,DMF和FG4592治療的腫瘤體積(圖7B)和腫瘤重量(圖7C)均顯著減少。通過BrdU摻入試驗(yàn)評(píng)估的腫瘤細(xì)胞增殖在DMF和FG4592聯(lián)合處理的HCT116、SW480和DLD1異種移植中也降低了(圖7D)。然而,在與DMF和FG4592共同處理的所有3個(gè)異種移植物中,tunel陽(yáng)性凋亡細(xì)胞的百分比都有所增加(圖7E)。總之,這些數(shù)據(jù)表明,缺氧腫瘤細(xì)胞對(duì)DMF治療非常脆弱,突出了一個(gè)潛在的治療窗口。
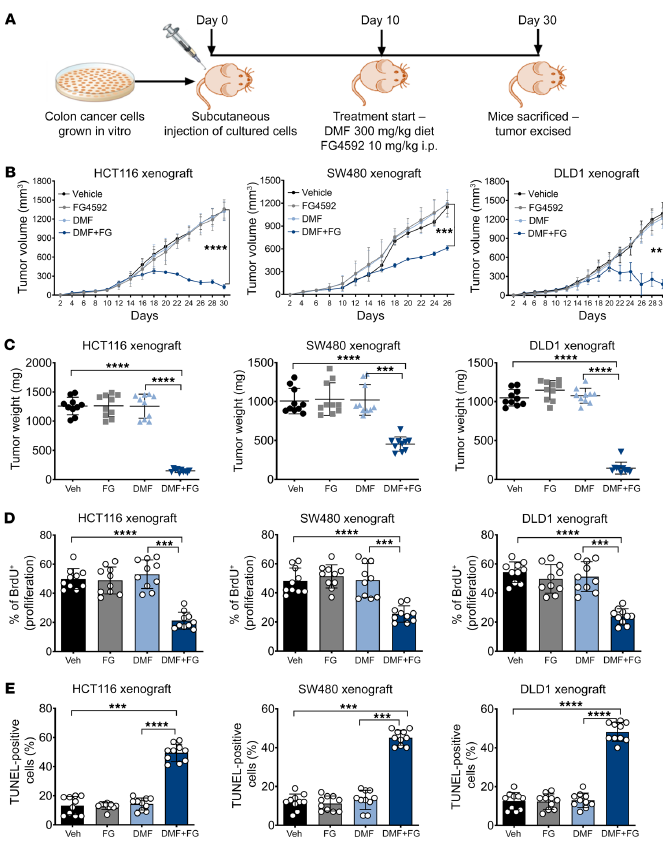
圖7. DMF和FG4592增強(qiáng)體內(nèi)CRC細(xì)胞死亡
8. DMF介導(dǎo)的體內(nèi)CRC細(xì)胞死亡依賴于HIF-2α
為了證實(shí)HIF-2α在DMF介導(dǎo)的體內(nèi)CRC細(xì)胞死亡中的作用,利用HIF-2α敲低HCT116細(xì)胞。在DMF和FG4592治療前,將穩(wěn)定的非靶標(biāo)擾亂和HIF-2α敲低的HCT116細(xì)胞皮下注射到免疫受損小鼠的兩側(cè),并允許其生長(zhǎng)10天(圖8A)。HIF-2α基因敲低的細(xì)胞對(duì)DMF和FG4592處理具有抗性。在DMF+FG4592處理的小鼠中,表達(dá)雜亂shRNA的細(xì)胞顯示腫瘤體積和重量顯著減少,而HIF-2α敲低的細(xì)胞則完全耐受(圖8,B和C)。同樣,在DMF+FG4592處理后,HIF-2α敲低細(xì)胞的腫瘤增殖和凋亡沒有改變(圖8,D和E)。這些數(shù)據(jù)表明,HIF-2α激活增加了體內(nèi)氧化細(xì)胞死亡的脆弱性。
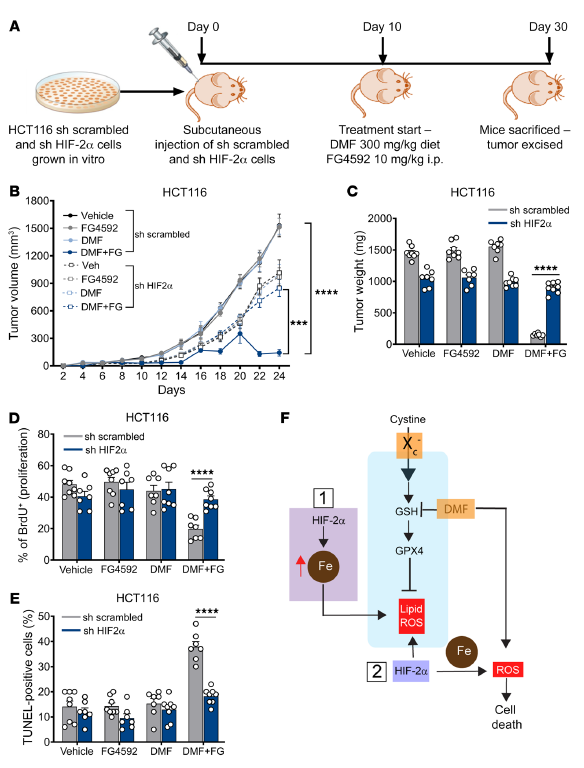
圖8. DMF介導(dǎo)的體內(nèi)CRC細(xì)胞死亡依賴于HIF-2α
總結(jié):
該研究揭示了HIF-2α在驅(qū)動(dòng)低氧CRC細(xì)胞對(duì)氧化應(yīng)激誘導(dǎo)化合物(如DMF)的合成致命性方面的作用,并揭示了利用這種內(nèi)在脆弱性進(jìn)行化療發(fā)展的潛力。






