NPM1突變急性髓系白血病的一種獨特亞型的生物學和治療意義

2021年,來自加拿大多倫多大學和加拿大溫哥華英屬哥倫比亞大學等團隊合作在Nature communication雜志上發表了文章“Biological and therapeutic implications of a unique subtype of NPM1 mutated AML.”。此報道描述了npm1突變AML患者的分子異質性。基于rna-seq的基因表達譜分析,確定了兩種新亞型,稱為原始型和committed型。基于基因表達、表觀基因組(ATAC-seq)和免疫表型(CyToF)的差異,在獨立的AML隊列中將亞型與特定的分子特征、疾病分化狀態和患者生存聯系起來。此外,表明了在缺乏FLT3-ITD的原始特征病例的治療中添加激酶抑制劑對AML可能有治療益處。
急性髓系白血病(AML)是一種基因和生物學上的異質性疾病,其特征是克隆擴增和突變的造血干細胞和祖細胞分化受損。在AML最常見的驅動突變中,NPM1基因第12外顯子的4堿基對插入是穩定的,在20% - 30%的病例中發生。由于其生物學意義和預后影響,NPM1突變在世界衛生組織(WHO)的髓性白血病分類中代表了一個獨特的白血病實體,并在預后和治療決策中發揮重要作用。
NPM1突變通常與誘導和鞏固化療后患者生存的良好影響相關。在NPM1突變的AML中,FLT3- ITD突變經常與DNMT3A突變同時發生,這本身與接受標準誘導治療的患者預后更差有關。大多數關于NPM1突變的AML的研究都集中在其他突變的同時發生,而突變型NPM1患者基因表達水平的異質性及其生物學意義尚未得到全面研究。
技術路線:

一、NPM1突變的AML聚集成兩個不同的組
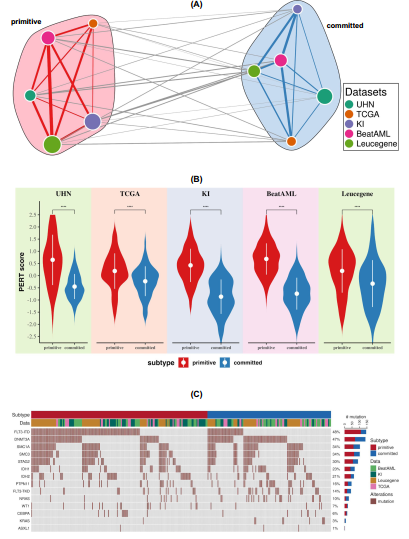
為了在391個npm1突變的AML樣本中定義一致的分子亞型,我們使用CoINcIDE12框架應用元聚類方法。我們的元聚類分析顯示在我們的數據概要中有兩個穩健的亞型(圖1A和補充圖1和2)。接下來,我們使用PERT算法13來闡明每個聚類中AML樣本的細胞組成。我們發現有一簇干細胞顯著富集,因此被標記為原始。與此相反,另一簇與髓系和造血分化相關的基因表達豐富,因此我們將其標記為committed亞型(圖1B)。兩個組在年齡、核型和白細胞計數等臨床病理參數方面沒有差異(卡方檢驗假發現率[FDR] >5%;補充表2 5)。確定關鍵驅動突變在原始和committed亞型中的分布(圖1C,補充討論中的亞型和突變部分和補充表6 17)。盡管亞型中富含某些突變(原始組的FLT3-ITD和承諾組的DNMT3A),驅動突變的遺傳改變對原始和committed亞型的預測較差(補充圖3 16和補充討論),基因突變和亞型之間的Matthews相關系數(MCC)較低(FLT3-ITD的MCC = 0.32, DNMT3A的MCC = 0.16;在precision-recall曲線(AUPRC = 0.62)值下,突變與亞型之間的多變量分析得到一個薄弱區域(Supplementary Fig. 7)。
二、npm1突變AML患者聚集的分子基礎
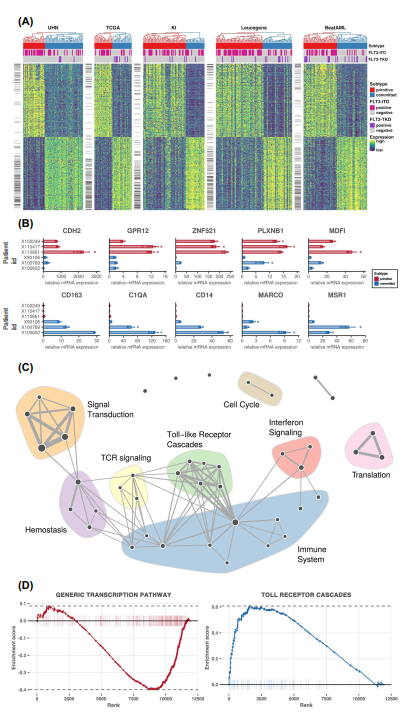
CDH2是鈣粘蛋白家族的一員,被認為是決定干細胞命運的調節因子15。類似地,G蛋白偶聯受體12 (GPR12)在原始亞型中上調,已知在干細胞維持和癌癥干細胞的體細胞重編程中發揮作用。MyoD家族抑制劑(MDFI)在原始亞型中表達增加,據報道它是WNT信號通路的調節因子,只在造血干細胞祖細胞中表達。鋅指蛋白521 (ZNF521)是一種轉錄因子,其在人類白血病細胞系中被敲低可以減少增殖但在原始亞型中卻有顯著的高表達。
CD163是一種免疫調節劑,是巨噬細胞清清體受體家族的成員,已知在單核細胞系的AML細胞中表達。在 committed cluster 中其他基因的高表達包括免疫相關基因,如C1QA, CD14和MARCO。msl1基因,一種已知的白血病干細胞增殖抑制因子,也在committed cluster中高表達。我們通過qPCR驗證了關鍵基因的差異表達(圖2B)。使用基因集合富集分析(GSEA),在committed 亞型中,免疫反應通路如干擾素- γ介導的信號通路、GPCR信號通路和toll樣受體(TLR)信號通路上調(圖2C, D, Supplementary Figs. 16, 18,與FLT3-ITD和DNMT3A突變的弱相關性一致。
三、原始表型和染色質可及性

雖然基因表達反映了細胞身份的活躍狀態,但順式調節元件(cre),包括啟動子和增強子,是決定細胞命運的潛在因素。因此,我們研究了npm1突變的AML樣本是否也會根據其順式調控景觀分層為原始和committed的集群。使用轉座酶可達染色質測序(ATAC-seq)可達染色質區域,以CREAM方法鑒定的核心為重點,根據表達譜對AML樣本進行聚類,但有一個例外(圖3A)。我們的研究結果表明,啟動子區形成了核心(啟動子:FDR = 11%,基因間:FDR = 2%;圖3B、C及補充圖19)。RUNX和GATA家族成員HOXC9和CTCF的dna結合位點基模只富集在原始亞型的COREs中,提示可能存在調控原始亞型基因的因素(圖3D,補充數據3).對承諾亞型中唯一可獲得的核心進行基序富集分析,確定了CEBP、ATF家族成員、OCT2、IRF2、NFkB-p65、ESRRB和EGR2識別的共識序列,提示它們在committed亞型中可能發揮的作用(圖3D)補充數據。
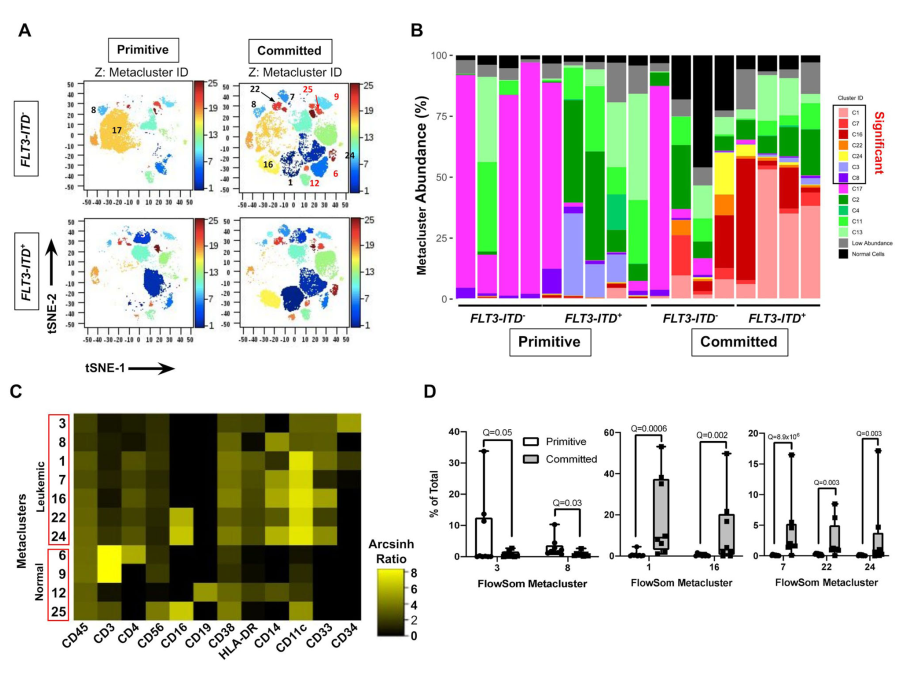
我們采用質譜耦合流式細胞儀(CyTOF)分析,在單細胞水平上探討9例原始AML npm1突變和8例committed npm1突變的患者的免疫表型差異。我們使用細胞術(diffcyt)27管道來計算定義具有相似高維表型的細胞群(免疫表型簇)。每個免疫表型聚類映射到二維t-隨機近鄰嵌入(t-SNE)圖上的離散區域(圖4A;補充圖20、21),證實它們表達不同的免疫表型。分析顯示,七種不同水平的CD45和造血祖細胞標記物(CD34, CD38)或骨髓單核細胞分化標記物(CD33, CD14, CD11c, CD16, HLA-DR)的惡性免疫表型集群在這兩種亞型之間差異豐富(圖4B,C)。確診病例中也包含較高豐度的非白血病免疫表型集群,包括CD45hi T (CD3+)、B (CD19+)和NK (CD3 CD56+ CD16+)細胞(補充圖20)。
npm1突變的AML原始病例中,免疫表型集群3和8的豐度明顯較高,這些集群3和8表型原始,由表達低水平的骨髓單核細胞分化標志物的CD34+ CD38lo(3)或CD34 CD38lo(8)細胞組成(圖4C, D,補充圖21)。非顯著白血病集群為CD34,但表達少量的骨髓單核細胞標記物。相比之下,npm1突變的急性髓細胞白血病committed 病例顯示出5個免疫表型集群(1,7,16,22和24)的豐度高于原始病例(圖4B, D)。這些免疫表型集群包括CD34?/lo CD38+ CD11c+細胞也表達CD33、CD14、CD16和HLA-DR的各種組合,顯示出異常的骨髓單核細胞分化(圖4C,補充圖21A)。在原始病例中,顯著原始免疫表型聚集的總豐度較低(平均值(9.4±11.4%),顯著分化免疫表型聚集(平均53±37%)。
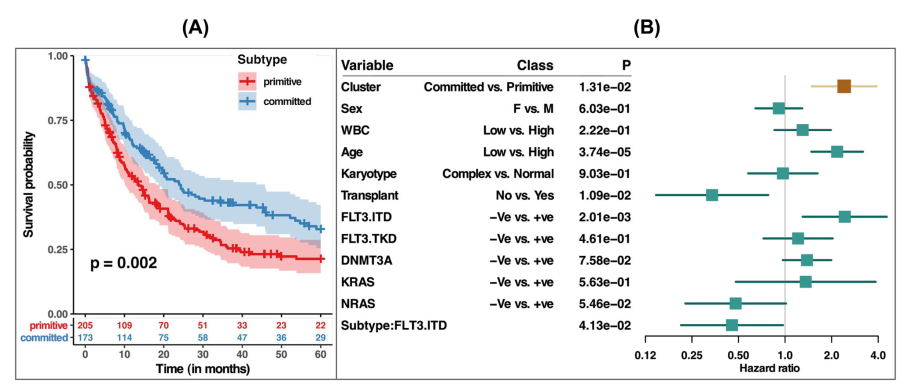
評估了原始亞型和committed亞型是否與患者總生存期相關(圖5A;補充圖22)。與committed亞型相比,原始亞型與明顯更差的生存率相關(Log-rank檢驗p = 0.002)。為了確定我們的聚類是否超出了已建立的預測因素,我們還擬合了一個多變量Cox比例風險模型,調整了臨床病理參數,如性別、白細胞計數、年齡、核型和突變,包括FLT3- itd、FLT3- TKD、DNMT3A、NRAS和KRAS。多變量分析顯示,原始亞型和committed亞型具有顯著的互補預后價值(p-值= 0.01,圖5B)。
六、原始亞型預示著對激酶抑制劑的敏感性增加
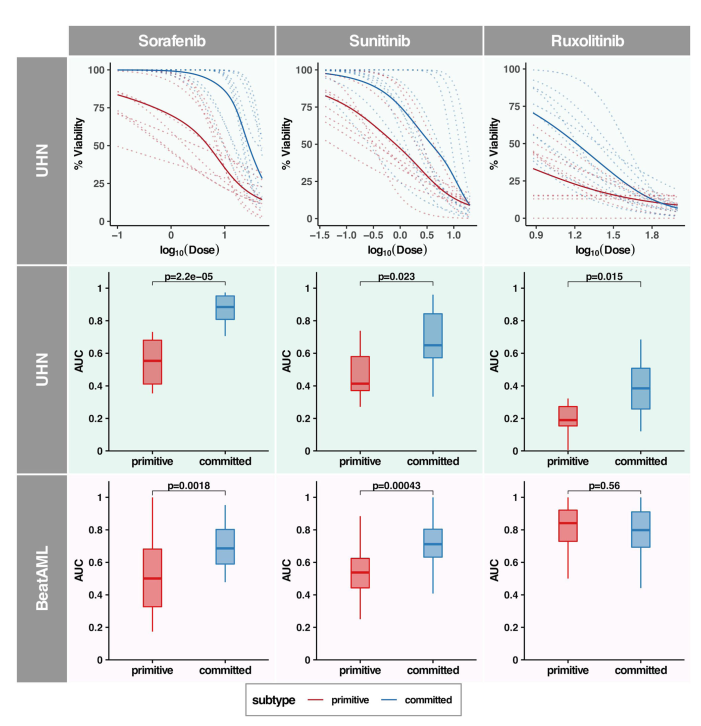
生成各化合物的藥物劑量響應曲線,并比較各亞型間曲線下面積(area under the curve, AUCd)(單個藥物劑量響應曲線見圖6、)。體外藥物篩選顯示,原始聚類患者樣本對索拉非尼、舒尼替尼和魯索利替尼的敏感性高于合并亞型(Wilcoxon秩和檢驗p-value分別= 2E 5、0.02和0.01;在UHN患者樣本中,Quizartinib的亞型間差異反應較弱,而伊馬替尼和達沙替尼的亞型間無差異(補充圖27)。
使用BeatAML33數據集,驗證原始和committed亞型對激酶抑制劑的反應之間的聯系,該數據集包含npm1突變AML患者樣本的體外藥物篩選。我們觀察到UHN和BeatAML數據集之間的良好一致性,原始聚類中的樣本對Sorafenib和Sunitinib表現出更高的敏感性(圖6)。有趣的是,Quizartinib在UHN隊列中有微弱的差異反應,但在BeatAML隊列中卻有統計學意義的差異。






